ما هو الأمونيوم NH4+؟
أيون الأمونيوم (NH4+) هو أيون متعدد الذرات موجب الشحنة ويتكون من ذرة نيتروجين واحدة وأربع ذرات هيدروجين. ويوجد عادة في الأسمدة والمركبات العضوية.
| اسم الأيوباك | أزانيوم |
| الصيغة الجزيئية | NH4+ |
| CAS رقم | 14798-03-9 |
| المرادفات | كاتيون الأمونيوم، رباعي هيدرونيتروجين (1+)، أمينونيوم، أزانيوم، كاتيون هيدريد النيتروجين، هيدرونيتروجين، أيون النيتروجين |
| إنتشي | إنتشي = 1S/H3N/h1H3/p+1 |
ملاحظة: يتعلق InChI بأيون الأمونيوم في أبسط صوره، مع هيدروجين متأين واحد. يمكن أن يختلف InChI الفعلي اعتمادًا على البيئة الكيميائية لأيون الأمونيوم.
صيغة الأمونيوم
صيغة أيون الأمونيوم هي NH4+. وهو كاتيون متعدد الذرات يتكون من ذرة نيتروجين واحدة وأربع ذرات هيدروجين. يتكون أيون الأمونيوم من بروتون الأمونيا (NH3) مع أيون الهيدروجين (H+). أيون الأمونيوم هو كاتيون شائع في المركبات غير العضوية والعضوية، بما في ذلك الأسمدة والمستحضرات الصيدلانية والمتفجرات.
كاتيون الأمونيوم
كاتيون الأمونيوم، المعروف أيضًا باسم NH4+، هو أيون متعدد الذرات موجب الشحنة يتكون من ذرة نيتروجين واحدة وأربع ذرات هيدروجين. ويتكون عندما تقبل الأمونيا (NH3) البروتون (H+) من الحمض، مما يؤدي إلى تكوين ملح الأمونيوم.
الكتلة المولية لأيونات الأمونيوم
الكتلة المولية لأيون الأمونيوم (NH4+) هي 18.04 جم/مول. يتم حساب هذه القيمة عن طريق إضافة الكتل الذرية لذرة نيتروجين واحدة (14.01 جم/مول) وأربع ذرات هيدروجين (1.01 جم/مول لكل منهما). تعد الكتلة المولية خاصية مهمة لأيون الأمونيوم لأنها تسمح بتحويل كتلته إلى مولات والعكس صحيح. وهذا مفيد في العديد من الحسابات الكيميائية، مثل تحديد كمية المواد المتفاعلة اللازمة للتفاعل الكيميائي.
درجة غليان أيونات الأمونيوم
وبما أن أيون الأمونيوم يوجد عادة في الملح، مثل كلوريد الأمونيوم (NH4Cl)، فإنه ليس لديه نقطة غليان خاصة به. وبدلا من ذلك، فإن درجة غليان كلوريد الأمونيوم، وهي 520 درجة مئوية، تتأثر بعوامل مختلفة مثل قوة الرابطة الأيونية بين أيون الأمونيوم وأيون الكلوريد، وكذلك حجم وشكل أيون الأمونيوم.
نقطة انصهار أيونات الأمونيوم
على غرار نقطة الغليان، لا يحتوي أيون الأمونيوم على نقطة انصهار لأنه ليس مادة موجودة في شكل نقي. ومع ذلك، فإن الأملاح التي تحتوي على أيون الأمونيوم، مثل نترات الأمونيوم (NH4NO3)، لها نقطة انصهار تبلغ 169.6 درجة مئوية. وتتأثر درجة انصهار نترات الأمونيوم بقوة الرابطة الأيونية بين أيون الأمونيوم وأيون النترات، وكذلك التركيب البلوري للمركب.
كثافة أيونات الأمونيوم جم/مل
كثافة أيون الأمونيوم (NH4+) لا تنطبق لأنه أيون متعدد الذرات ولا يوجد ككيان منفصل. ومع ذلك، فإن الأملاح التي تحتوي على أيون الأمونيوم، مثل كبريتات الأمونيوم (NH4)2SO4، لها كثافة 1.77 جم/سم3 عند درجة حرارة الغرفة. وتتأثر كثافة الأملاح التي تحتوي على أيون الأمونيوم بعوامل مختلفة، بما في ذلك حجم وشكل الأيونات، وقوة الرابطة الأيونية، والبنية البلورية للمركب.
الوزن الجزيئي لأيونات الأمونيوم
يبلغ الوزن الجزيئي لأيون الأمونيوم (NH4+) 18.04 جم/مول، ويتم حسابه عن طريق إضافة الكتل الذرية لذرة نيتروجين واحدة وأربع ذرات هيدروجين. يعد الوزن الجزيئي خاصية مهمة لأيون الأمونيوم لأنه يسمح بتحويل كتلته إلى مولات والعكس صحيح. وهذا مفيد في العديد من الحسابات الكيميائية، مثل تحديد كمية المواد المتفاعلة اللازمة للتفاعل الكيميائي.
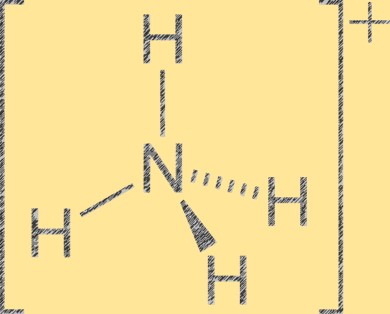
هيكل أيونات الأمونيوم
يحتوي أيون الأمونيوم (NH4+) على هندسة جزيئية رباعية السطوح مع ذرة نيتروجين واحدة في المركز وأربع ذرات هيدروجين في زوايا رباعي السطوح. تحتوي ذرة النيتروجين على شحنة رسمية موجبة قدرها +1، في حين أن كل ذرة هيدروجين لها شحنة رسمية قدرها -1. أيون الأمونيوم عبارة عن كاتيون متعدد الذرات يتكون من بروتون الأمونيا (NH3) مع أيون الهيدروجين (H+). أيون الأمونيوم هو كاتيون شائع في المركبات غير العضوية والعضوية، بما في ذلك الأسمدة والمستحضرات الصيدلانية والمتفجرات.
| مظهر | غاز صلب بلوري أبيض أو عديم اللون |
| جاذبية معينة | غير قابل للتطبيق (أيون متعدد الذرات) |
| لون | عديم اللون |
| يشم | عديم الرائحة |
| الكتلة المولية | 18.04 جرام/مول |
| كثافة | غير قابل للتطبيق (أيون متعدد الذرات)، تختلف كثافة الملح (على سبيل المثال 1.77 جم/سم مكعب لكبريتات الأمونيوم) |
| نقطة الانصهار | غير قابل للتطبيق (أيون متعدد الذرات)، تختلف نقطة انصهار الأملاح (على سبيل المثال 169.6 درجة مئوية لنترات الأمونيوم) |
| نقطة الغليان | غير قابل للتطبيق (أيون متعدد الذرات)، تختلف نقطة غليان الأملاح (على سبيل المثال 520 درجة مئوية لكلوريد الأمونيوم) |
| نقطة فلاش | غير قابل للتطبيق (أيون متعدد الذرات) |
| الذوبان في الماء | قابل للذوبان جدا (الامتزاج تماما) في الماء |
| الذوبان | قابل للذوبان في الكحول والأمونيا السائلة |
| ضغط البخار | غير قابل للتطبيق (أيون متعدد الذرات) |
| كثافة بخار | غير قابل للتطبيق (أيون متعدد الذرات) |
| pKa | 9.25 (حمض مترافق، كاتيون الأمونيوم) |
| الرقم الهيدروجيني | 7 (محايد) في محلول مائي |
ملحوظة: قد تختلف القيم الواردة في الجدول حسب الشكل الكيميائي والظروف المحددة لأيون الأمونيوم.
السلامة ومخاطر أيونات الأمونيوم
يعتبر أيون الأمونيوم، في شكله النقي، آمنًا وغير سام بشكل عام. ومع ذلك، مثل العديد من المركبات الكيميائية، يمكن لأيون الأمونيوم أن يشكل بعض المخاطر والمخاطر، خاصة إذا تم التعامل معه أو استخدامه بشكل غير مناسب. يمكن لأيون الأمونيوم أن يطلق غاز الأمونيا السام عندما يتفاعل مع قواعد قوية أو أحماض قوية. وقد يشكل أيضًا خطر الحريق والانفجار عند تعرضه للحرارة أو اللهب. بالإضافة إلى ذلك، فإن التعرض لتركيزات عالية من أيونات الأمونيوم أو مشتقاته يمكن أن يسبب تهيج العينين والجلد والجهاز التنفسي. من المهم اتباع بروتوكولات السلامة المناسبة والتعامل مع أيون الأمونيوم ومشتقاته بعناية لتجنب المخاطر المحتملة.
| رموز الخطر | لم يتم تخصيص أي شيء لأيون الأمونيوم النقي |
| وصف الأمان | ضار إذا ابتلع أو استنشاقها أو امتصاصها عن طريق الجلد. يسبب تهيج الجلد والعينين والجهاز التنفسي. قد يطلق غاز الأمونيا السام. قد يشكل خطر الحريق والانفجار. |
| معرف | 3077 (بالنسبة لمركبات الأمونيوم، بما في ذلك أملاح الأمونيوم) |
| رمز النظام المنسق | 2827.10.00 (لكلوريد الأمونيوم وكربونات الأمونيوم وأملاح الأمونيوم الأخرى) |
| فئة الخطر | 9 (المواد والأشياء الخطرة المتنوعة) لمركبات الأمونيوم، الفئة 8 (المواد المسببة للتآكل) لمحلول هيدروكسيد الأمونيوم |
| مجموعة التعبئة | III (لمركبات الأمونيوم) |
| تسمم | تعتبر بشكل عام غير سامة في شكلها النقي، ولكنها يمكن أن تطلق غاز الأمونيا السام. قد تكون مركبات الأمونيوم ومشتقاتها سامة أو ضارة بصحة الإنسان والبيئة اعتمادًا على خصائصها واستخدامها. |
طرق تصنيع أيونات الأمونيوم
يمكن تصنيع أيون الأمونيوم باستخدام مجموعة متنوعة من الطرق، بما في ذلك التفاعلات الكيميائية والعمليات البيولوجية.
إحدى الطرق الشائعة لتصنيع أيون الأمونيوم هي تفاعل غاز الأمونيا مع حمض، مثل حمض الهيدروكلوريك أو حمض الكبريتيك، لإنتاج ملح الأمونيوم. يتضمن التفاعل إزاحة أيونات الهيدروجين (H+) في الحمض بواسطة جزيئات الأمونيا، مما يؤدي إلى تكوين كاتيون الأمونيوم (NH4+) والأنيون المقابل للحمض (مثل الكلوريد والكبريتات). ويمكن تنقية ملح الأمونيوم الناتج وتبلوره للحصول على أيون الأمونيوم.
يمكن أن تؤدي العمليات البيولوجية، مثل تحلل المواد العضوية بواسطة الميكروبات، إلى تكوين أيونات الأمونيوم. خلال هذه العملية، يتم تفكيك المركبات المحتوية على النيتروجين بواسطة البكتيريا والكائنات الحية الدقيقة الأخرى، مما يؤدي إلى إنتاج الأمونيا وفي النهاية أيونات الأمونيوم. تُعرف هذه العملية باسم الأمونيا وهي خطوة مهمة في دورة النيتروجين.
هناك طريقة أخرى لتصنيع أيون الأمونيوم وهي استخدام عملية هابر بوش، والتي تتضمن تفاعل غاز النيتروجين وغاز الهيدروجين في وجود محفز عند ضغط ودرجة حرارة مرتفعين. يمكن بعد ذلك أن يتفاعل غاز الأمونيا الناتج مع حمض لإنتاج أيون الأمونيوم.
استخدامات أيونات الأمونيوم
لأيون الأمونيوم استخدامات مختلفة في البيئات الصناعية والزراعية والمختبرية.
إنه يخدم مجموعة واسعة من البيئات الصناعية والزراعية والمختبرية، حيث يعمل في المقام الأول كسماد في الزراعة، مما يوفر النيتروجين المتاح بسهولة للنباتات مع تقليل درجة حموضة التربة.
تستخدم الصناعة الكيميائية أيون الأمونيوم كعنصر رئيسي في إنتاج مركبات مختلفة، مثل الأسمدة والمتفجرات والمستحضرات الصيدلانية، وكذلك في تصنيع المضادات الحيوية وغيرها من المستحضرات الصيدلانية. يعمل أيون الأمونيوم أيضًا كمواد متفجرة على شكل نترات الأمونيوم.
في المختبرات، يستخدم الباحثون أيون الأمونيوم كمادة متفاعلة في العديد من التفاعلات الكيميائية، مثل تفاعلات الترسيب والتخليق العضوي، وكعامل منظم لتثبيت الرقم الهيدروجيني للمحلول.
بالإضافة إلى ذلك، يتم استخدام أيون الأمونيوم في منتجات التنظيف المنزلية كعامل مضاد للميكروبات بسبب قدرته على قتل البكتيريا والفطريات.
الاستخدامات المتعددة لأيون الأمونيوم وتعدد استخداماته تجعله مركبًا أساسيًا في مختلف الصناعات والتطبيقات.
