أكسيد الفوسفور (P2O5) مركب كيميائي. ويتكون من اتحاد ذرتين فوسفور وخمس ذرات أكسجين.
| اسم الأيوباك | ثنائي أكسيد الفوسفور |
| الصيغة الجزيئية | P2O5 |
| CAS رقم | 1314-56-3 |
| المرادفات | أنهيدريد الفوسفوريك، أكسيد الفوسفور (V)، خامس أكسيد ثنائي الفوسفور |
| إنتشي | إنشي=1S/2O.P2/c2*1-3-2 |
خصائص أكسيد الفوسفور
صيغة أكسيد الفوسفور
صيغة خامس أكسيد ثنائي الفوسفور هي P2O5. ويتكون من ذرتين فوسفور وخمس ذرات أكسجين. تمثل هذه الصيغة الكيميائية نسبة العناصر الموجودة في المركب.
الكتلة المولية لأكسيد الفوسفور
يتم حساب الكتلة المولية لخامس أكسيد ثنائي الفوسفور (P2O5) عن طريق إضافة الكتل الذرية للعناصر المكونة له. يمتلك الفوسفور كتلة ذرية تبلغ حوالي 31.0 جرامًا لكل مول، بينما تبلغ الكتلة الذرية للأكسجين حوالي 16.0 جرامًا لكل مول. وبالتالي فإن الكتلة المولية لـ P2O5 تبلغ حوالي 141.9 جرامًا لكل مول.
نقطة غليان أكسيد الفوسفور
لا يحتوي خامس أكسيد ثنائي الفوسفور على نقطة غليان محددة. وبدلاً من ذلك، فإنه يخضع لتفاعل كيميائي عند تسخينه، ويتحول إلى حمض الفوسفوريك (H3PO4) ويطلق الحرارة في هذه العملية. ولذلك، فإنه ليس لديه نقطة غليان محددة بشكل جيد مثل العديد من المركبات الأخرى.
نقطة انصهار أكسيد الفوسفور
يحتوي خامس أكسيد ثنائي الفوسفور (P2O5) على نقطة انصهار تبلغ حوالي 340 درجة مئوية (644 درجة فهرنهايت). عند درجة الحرارة هذه، يتحول المركب الصلب إلى الحالة السائلة. من المهم أن نلاحظ أن خامس أكسيد ثنائي الفوسفور شديد الرطوبة، مما يعني أنه يمتص الرطوبة من الهواء بسهولة.
كثافة أكسيد الفوسفور جم/مل
تبلغ كثافة خامس أكسيد ثنائي الفوسفور حوالي 2.39 جرام لكل ملليلتر (جم / مل). الكثافة هي مقياس الكتلة لكل وحدة حجم، وتشير هذه القيمة إلى مدى ثقل المادة أو ضغطها. تساهم كثافة خامس أكسيد ثنائي الفوسفور في خصائصه الفيزيائية وسلوكه في مختلف التطبيقات.
الوزن الجزيئي لأكسيد الفوسفور
يبلغ الوزن الجزيئي لخامس أكسيد ثنائي الفوسفور (P2O5) حوالي 141.9 جرامًا لكل مول. تمثل هذه القيمة مجموع الكتل الذرية للفوسفور والأكسجين في المركب. غالبًا ما يستخدم الوزن الجزيئي في الحسابات التي تتضمن التفاعلات الكيميائية وقياس العناصر الكيميائية للمركبات.
هيكل أكسيد الفوسفور
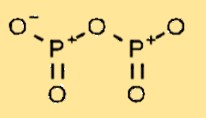
يحتوي خامس أكسيد ثنائي الفوسفور على بنية جزيئية تتكون من ذرتين فوسفور مرتبطتين بخمس ذرات أكسجين. يشكل ترتيب الذرات بنية دائرية، حيث ترتبط كل ذرة فوسفور بذرتي أكسجين وتتشارك رابطة مزدوجة مع ذرة الفسفور المجاورة.
ذوبان أكسيد الفوسفور
خامس أكسيد ثنائي الفوسفور غير قابل للذوبان في الماء. يتفاعل بقوة مع الماء ليشكل حمض الفوسفوريك، ويطلق الحرارة. ومع ذلك، فهو قابل للذوبان في بعض المذيبات العضوية مثل ثاني كبريتيد الكربون والكلوروفورم. تلعب خصائص ذوبان خامس أكسيد ثنائي الفوسفور دورًا في تفاعله الكيميائي وتطبيقاته.
| مظهر | مادة صلبة بلورية بيضاء |
| جاذبية معينة | 2.39 جرام/مل |
| لون | عديم اللون |
| يشم | عديم الرائحة |
| الكتلة المولية | 141.9 جرام/مول |
| كثافة | 2.39 جرام/مل |
| نقطة الانصهار | 340 درجة مئوية (644 درجة فهرنهايت) |
| نقطة الغليان | يتفاعل لتكوين حمض الفوسفوريك |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | يتفاعل مع الماء لتكوين حمض الفوسفوريك |
| الذوبان | قابل للذوبان في المذيبات العضوية مثل ثاني كبريتيد الكربون والكلوروفورم |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | غير قابل للتطبيق |
السلامة ومخاطر أكسيد الفوسفور
يشكل خامس أكسيد ثنائي الفوسفور (P2O5) بعض مخاطر السلامة ويجب توخي الحذر عند التعامل معه. يتفاعل بعنف مع الماء، ويطلق الحرارة ويشكل حمض الفوسفوريك، الذي يمكن أن يسبب حروقًا وتهيجًا في الجلد والعينين والجهاز التنفسي. ومن المهم تجنب ملامسة المادة واستخدام معدات الحماية المناسبة، مثل القفازات والنظارات الواقية وجهاز التنفس الصناعي، عند العمل مع خامس أكسيد ثنائي الفوسفور. بالإضافة إلى ذلك، من الضروري تخزين المركب في حاوية مغلقة بإحكام، بعيدًا عن الرطوبة والمواد غير المتوافقة. ويجب توفير التهوية الكافية لمنع تراكم الأبخرة.
| رموز الخطر | تآكل، ضارة |
| وصف الأمان | – يسبب حروقاً شديدة في الجلد وتلفاً في العين – قد يكون ضاراً في حالة البلع أو الاستنشاق – يتفاعل بعنف مع الماء – يُحفظ بعيداً عن الرطوبة والمواد غير المتوافقة |
| أرقام تعريف الأمم المتحدة | أ 1807 |
| رمز النظام المنسق | 2819.10.90 |
| فئة الخطر | الفئة 8 (المواد المسببة للتآكل) |
| مجموعة التعبئة | PG II (خطر متوسط) |
| تسمم | سامة للحياة المائية، وقد تسبب تأثيرات ضارة طويلة المدى على البيئة المائية |
طرق تصنيع أكسيد الفوسفور
يمكن استخدام طرق مختلفة لتصنيع خامس أكسيد ثنائي الفوسفور (P2O5).
تتضمن الطريقة الشائعة حرق الفوسفور في وجود الأكسجين الزائد. ينتج عن هذا التفاعل خامس أكسيد الفوسفور على شكل بقايا صلبة بيضاء. معادلة هذه العملية هي P4 + 5O2 → 2P2O5.
تتضمن الطريقة الأخرى الأكسدة الخاضعة للرقابة لمركبات الفوسفور، مثل ثلاثي كلوريد الفوسفور (PCl3) أو ثلاثي بروميد الفوسفور (PBr3) ، باستخدام الأكسجين أو الهواء. ويحدث التفاعل عادة عند درجات حرارة عالية ويكون المنتج الناتج هو خامس أكسيد الفوسفور.
للحصول على خامس أكسيد ثنائي الفوسفور، يمكن تجفيف حمض الفوسفوريك (H3PO4) عن طريق تسخينه عند درجة حرارة عالية. تقوم هذه العملية بإزالة جزيئات الماء وينتج عنها تكوين خامس أكسيد الفوسفور.
هناك طريقة أخرى لتحضير خامس أكسيد ثنائي الفوسفور تتضمن التحلل الحراري لأملاح فوسفات معينة. على سبيل المثال، يؤدي تسخين فوسفات هيدروجين الأمونيوم (NH4H2PO4) أو فوسفات الأمونيوم ((NH4)3PO4) إلى تكوين خامس أكسيد الفوسفور.
عند تصنيع خامس أكسيد ثنائي الفوسفور، من الأهمية بمكان توخي الحذر بسبب تفاعله وتوليد الحرارة أثناء تفاعلات محددة. وينبغي اتباع احتياطات السلامة المناسبة، مثل العمل في منطقة جيدة التهوية وارتداء معدات الحماية المناسبة.
توفر هذه الطرق الاصطناعية سبلًا للحصول على خامس أكسيد ثنائي الفوسفور، والذي يجد تطبيقات في مجالات مختلفة، بما في ذلك إنتاج حمض الفوسفوريك، والأسمدة، والمواد الوسيطة الكيميائية.
استخدامات أكسيد الفوسفور
يجد خامس أكسيد ثنائي الفوسفور (P2O5) تطبيقات مختلفة في العديد من الصناعات بسبب خصائصه الفريدة. فيما يلي بعض الاستخدامات الشائعة لخامس أكسيد ثنائي الفوسفور:
- إنتاج حمض الفوسفوريك: يستخدم تصنيع حمض الفوسفوريك على نطاق واسع خامس أكسيد ثنائي الفوسفور كسلائف رئيسية. يستخدم حمض الفوسفوريك في العديد من التطبيقات في الأسمدة والمضافات الغذائية ومواد التنظيف.
- صناعة الأسمدة: يلعب خامس أكسيد ثنائي الفوسفور دوراً أساسياً في إنتاج الأسمدة الفوسفاتية المختلفة، بما في ذلك أسمدة السوبر فوسفات وأسمدة فوسفات الأمونيوم. توفر هذه الأسمدة للنباتات العناصر الغذائية الأساسية لتعزيز النمو الصحي.
- الوسطيات الكيميائية: يرتبط تخليق المركبات العضوية المختلفة، مثل المستحضرات الصيدلانية والمبيدات الحشرية ومثبطات اللهب، بخامس أكسيد ثنائي الفوسفور كوسيط كيميائي.
- المجفف: خامس أكسيد ثنائي الفوسفور له صلة قوية بالماء ويعمل كمجفف. يتم استخدامه في العديد من التفاعلات الكيميائية لإزالة الماء وتعزيز التفاعلات المطلوبة.
- المحفز: يعمل خامس أكسيد ثنائي الفوسفور كمحفز في تفاعلات كيميائية محددة. فهو يسهل هذه التفاعلات عن طريق تقليل طاقة التنشيط وبالتالي زيادة معدلات التفاعل.
- المجفف: إن الطبيعة الاسترطابية لخامس أكسيد ثنائي الفوسفور تجعله مناسبًا للاستخدام كمجفف في التطبيقات الحساسة للرطوبة. يمتص ويزيل الرطوبة بشكل فعال من البيئة.
- صناعة الزجاج: تشتمل تركيبات الزجاج على خامس أكسيد ثنائي الفوسفور لتعديل خصائصه، بما في ذلك التمدد الحراري ومعامل الانكسار. النظارات المتخصصة، مثل النظارات البصرية ونظارات البورسليكات، تستخدمها بنشاط.
- معالجة الأسطح المعدنية: تستخدم معالجات الأسطح المعدنية، مثل الفوسفات، خامس أكسيد ثنائي الفوسفور لتحسين مقاومة التآكل وتحسين التصاق الطلاء بالأسطح المعدنية.
تسلط هذه التطبيقات المتنوعة الضوء على أهمية خامس أكسيد ثنائي الفوسفور في صناعات تتراوح من الزراعة إلى الأدوية، مما يجعله مركبًا قيمًا ومفيدًا على نطاق واسع.
أسئلة:
س: ما هو عدد تأكسد الفسفور في أيون PO ؟
ج: عدد تأكسد الفوسفور في أيون PO هو +5.
س: ما هي حالة الأكسدة لذرة الفسفور الفردية في PO43−؟
ج: حالة الأكسدة لذرة الفسفور الفردية في PO43− هي +5.
س: ما هو عدد تأكسد الفوسفور؟
ج: يمكن أن يختلف عدد تأكسد الفوسفور، لكنه يظهر عمومًا على شكل +3 أو +5.
س: ما اسم المركب P2O5 ؟
ج: اسم المركب P2O5 هو خامس أكسيد الفوسفور (V).
س: ما هو P2O5؟
ج: P2O5 هو مركب كيميائي يسمى خامس أكسيد الفوسفور (V).
س: ما هو الاسم الصحيح لـ P2O5؟
ج: الاسم الصحيح لـ P2O5 هو خامس أكسيد الفوسفور (V).
س: ما هو اسم P2O5؟
ج: اسم P2O5 هو خامس أكسيد الفوسفور (V).
س: هل P2O5 مذبذب؟
ج: لا، P2O5 ليس مذبذبًا. وهو أكسيد حمضي.
س: ما هو الأسمدة P2O5؟
ج: يشير سماد P2O5 إلى الأسمدة التي تحتوي على خامس أكسيد الفوسفور (V) (P2O5) كمصدر للفوسفور المهم لنمو النبات.
س: هل P2O5 حمضي أم أساسي؟
ج: P2O5 مركب حمضي.
س: هل P2O5 مركب أيوني؟
ج: لا، P2O5 مركب تساهمي.
س: كيف يتم حساب P2O5 في الأسمدة؟
ج: لحساب كمية P2O5 في الأسمدة، قم بضرب نسبة P2O5 في وزن السماد.
س: خواص P2O5، قابل للذوبان؟
ج: P2O5 قليل الذوبان في الماء ولكنه يتفاعل بسهولة مع الماء لتكوين حمض الفوسفوريك.
س: كم كيلوجرام من P في 14% P2O5؟
ج: لحساب كمية الفوسفور (P) في 14% P2O5، اضرب وزن السماد في 0.14.
