أكسيد البورون (B2O3) هو مركب يتكون من الرابطة الكيميائية بين البورون والأكسجين. يتم استخدامه في إنتاج الزجاج والسيراميك بسبب درجة انصهاره العالية.
| اسم الأيوباك | أكسيد البورون |
| الصيغة الجزيئية | B2O3 |
| CAS رقم | 1303-86-2 |
| المرادفات | ثالث أكسيد تريبورون، أكسيد البوريك، أكسيد البورون (III). |
| إنتشي | إنتشي = 1S/B2O3/c3-1-5-2(4)6-1 |
خصائص أكسيد البورون
صيغة أكسيد البورون
الصيغة الكيميائية لأكسيد البوريك هي B2O3. ويمثل نسبة ذرات البورون إلى ذرات الأكسجين في المركب. تشير الأرقام القياسية إلى وجود ذرتي بورون وثلاث ذرات أكسجين في كل جزيء من أكسيد البوريك.
الكتلة المولية لأكسيد البورون
يمكن حساب الكتلة المولية لأكسيد البوريك عن طريق إضافة الكتل الذرية للعناصر المكونة له. تبلغ الكتلة الذرية للبورون 10.81 جم / مول، بينما تبلغ الكتلة الذرية للأكسجين 16.00 جم / مول. عن طريق ضرب الكتل الذرية بعدد الذرات وإضافتها، يتم تحديد الكتلة المولية لأكسيد البوريك لتكون 69.62 جم/مول.
نقطة غليان أكسيد البورون
يتمتع أكسيد البوريك بنقطة غليان عالية تبلغ حوالي 1860 درجة مئوية. وهذا يعني أنه عند الضغط الجوي العادي، يتطلب الأمر طاقة كبيرة لتحويل أكسيد البوريك من حالته السائلة إلى حالته الغازية.
نقطة انصهار أكسيد البورون
تبلغ درجة انصهار أكسيد البوريك حوالي 450 درجة مئوية. عند درجة الحرارة هذه، يتغير أكسيد البوريك الصلب إلى الحالة السائلة. نقطة انصهاره المنخفضة نسبيًا تجعله مناسبًا لمختلف التطبيقات الصناعية.
كثافة أكسيد البورون جم/مل
تبلغ كثافة أكسيد البوريك حوالي 2.46 جم / مل. تشير الكثافة إلى الكتلة لكل وحدة حجم من المادة. تشير كثافة أكسيد البوريك إلى أنه كثيف نسبيًا، مما يسمح له بالتدفق في معظم السوائل.
الوزن الجزيئي لأكسيد البورون
الوزن الجزيئي لأكسيد البوريك، ويسمى أيضًا الكتلة المولية، هو 69.62 جم/مول. تمثل هذه القيمة كتلة مول واحد من المركب وهي مفيدة لحساب كمية أكسيد البوريك في عينة معينة.
هيكل أكسيد البورون
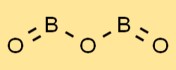
يتمتع أكسيد البوريك ببنية فريدة من نوعها، تضم مجموعة من وحدات BO3 المستوية المثلثية. ذرات البورون محاطة بثلاث ذرات أكسجين مرتبة بشكل مثلث. هذا الترتيب يعطي أكسيد البوريك خصائصه المميزة واستقراره.
ذوبان أكسيد البورون
أكسيد البوريك غير قابل للذوبان في الماء وفي معظم المذيبات العضوية. قابليته للذوبان محدودة في الأحماض مثل حمض الكبريتيك وحمض الهيدروكلوريك. ويساهم هذا الذوبان المنخفض في استقراره وفائدته في مختلف التطبيقات، مثل إنتاج الزجاج والسيراميك.
| مظهر | الصلبة البيضاء |
| جاذبية معينة | 2.46 جم/مل |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 69.62 جرام/مول |
| كثافة | 2.46 جم/مل |
| نقطة الانصهار | 450 درجة مئوية |
| نقطة الغليان | 1860 درجة مئوية |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | لا يتحلل في الماء |
| الذوبان | محدودية الذوبان في الأحماض، مثل حمض الكبريتيك وحمض الهيدروكلوريك |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | غير قابل للتطبيق |
يرجى ملاحظة أن بعض الخصائص مثل نقطة الوميض وضغط البخار وكثافة البخار وpKa وpH غير قابلة للتطبيق أو لم يتم الإبلاغ عنها بالنسبة لأكسيد البوريك.
السلامة ومخاطر أكسيد البورون
يطرح أكسيد البوريك بعض اعتبارات السلامة والمخاطر. قد يؤدي الاتصال المباشر بمسحوق أو غبار أكسيد البوريك إلى تهيج الجلد والعينين والجهاز التنفسي. من المهم التعامل معها بعناية واستخدام معدات الحماية الشخصية المناسبة مثل القفازات والنظارات الواقية. استنشاق جزيئات أكسيد البوريك يمكن أن يسبب تهيج الجهاز التنفسي، لذلك ينصح بالعمل في مناطق جيدة التهوية. في حالة الابتلاع العرضي، يجب طلب العناية الطبية على الفور. أكسيد البوريك غير قابل للاشتعال وليس له نقطة وميض. كما هو الحال مع أي مادة كيميائية، يوصى باتباع إرشادات التعامل والتخزين المناسبة لضمان الاستخدام الآمن.
| رموز الخطر | غير مصنف |
| وصف الأمان | تجنب ملامسة الجلد والعينين. استخدام في منطقة جيدة التهوية. ارتداء معدات الحماية. |
| أرقام تعريف الأمم المتحدة | غير قابل للتطبيق |
| رمز النظام المنسق | 2810.00.2000 |
| فئة الخطر | غير مصنف |
| مجموعة التعبئة | غير قابل للتطبيق |
| تسمم | سمية منخفضة إلى متوسطة. قد يسبب تهيجًا عن طريق التلامس أو الاستنشاق. |
يرجى ملاحظة أن أكسيد البوريك لا يحمل رموز خطر أو تعريف الأمم المتحدة أو فئة الخطر أو مجموعة التعبئة. من المهم اتباع إرشادات وممارسات السلامة العامة عند التعامل مع أكسيد البوريك واستخدامه لتقليل مخاطر التعرض وضمان الاستخدام الآمن.
طرق تصنيع أكسيد البورون
طرق مختلفة تسمح بتخليق أكسيد البوريك. الطريقة المستخدمة على نطاق واسع هي تسخين عنصر البورون في وجود الأكسجين أو الهواء لتكوين أكسيد البوريك. تتضمن الطريقة الأخرى تفاعل هاليدات البورون، مثل ثلاثي كلوريد البورون (BCl3) أو ثلاثي بروميد البورون (BBr3)، مع الماء، مما يؤدي إلى تكوين أكسيد البوريك.
بالإضافة إلى ذلك، يمكن للمركبات المحتوية على البورون مثل نيتريد البورون أو ثلاثي كبريتيد البورون أن تخضع للتحلل المائي مع الماء لإنتاج أكسيد البوريك. التحلل الحراري للبورات، مثل بورات الصوديوم أو البوراكس ، عند تعرضها للحرارة ينتج أيضًا أكسيد البوريك.
من المهم ملاحظة أن اختيار طريقة تصنيع محددة يعتمد على النقاء المطلوب وكمية وتطبيق أكسيد البوريك. كل طريقة لها مزايا وقد تكون مناسبة لمواقف مختلفة.
استخدامات أكسيد البورون
يجد أكسيد البوريك تطبيقات مختلفة في مختلف الصناعات. وهذه بعض استخداماته:
- إنتاج الزجاج والسيراميك: يعتبر أكسيد البوريك عنصراً أساسياً في صناعة الزجاج والسيراميك. فهو يمنح المنتجات الزجاجية خصائص مرغوبة مثل مقاومة الحرارة والشفافية والمتانة.
- مثبطات اللهب: يستخدم المصنعون أكسيد البوريك كمثبط للهب في مواد مثل المنسوجات والبلاستيك والمنتجات الخشبية. ويعمل أكسيد البوريك على تقليل قابلية هذه المواد للاشتعال، مما يضمن زيادة السلامة.
- زجاج البورسليكات: يلعب أكسيد البوريك دورًا حيويًا كأحد مكونات زجاج البورسليكات، المعروف بتمدده الحراري المنخفض ومقاومته العالية للحرارة. تستخدم الصناعات هذا النوع من الزجاج في معدات المختبرات وأدوات المطبخ والأجهزة البصرية المتطورة.
- الألياف المتخصصة: يتضمن إنتاج الألياف المتخصصة، بما في ذلك ألياف البورون وألياف نيتريد البورون، استخدام أكسيد البوريك. تمتلك هذه الألياف خصائص ميكانيكية وحرارية استثنائية، مما يجعلها مناسبة لصناعات الطيران والسيارات والتكنولوجيا الفائقة.
- كيماويات البورون: يعمل أكسيد البوريك كمقدمة لتخليق العديد من المواد الكيميائية للبورون، مثل البورات وهيدريدات البورون. تجد هذه المواد الكيميائية تطبيقات في الزراعة والأدوية وأنظمة تخزين الطاقة.
- تدفقات اللحام وعوامله: يقلل أكسيد البوريك من درجة انصهار المواد ويحسن سيولتها، مما يجعله تدفقًا فعالاً في العمليات المعدنية. يعمل على تحسين رابطة الأسطح المعدنية عند استخدامه كعامل لحام.
- المحفزات: تستفيد التفاعلات الكيميائية من محفزات أكسيد البوريك لأنها تعزز التفاعلات المرغوبة وتزيد من معدلات التفاعل.
- صناعة أشباه الموصلات: يلعب أكسيد البوريك دوراً حاسماً في إنتاج أشباه الموصلات. إنه بمثابة مادة منشطة لتعديل الخواص الكهربائية للسيليكون بشكل فعال.
تسلط المجموعة الواسعة من تطبيقات أكسيد البوريك الضوء على تنوعه وأهميته في مختلف الصناعات، مما يساهم في التقدم في التكنولوجيا والسلامة وعلوم المواد.
أسئلة:
س: ما هي حالة أكسدة البورون في B2O3؟
ج: حالة أكسدة البورون في B2O3 هي +3.
س: ما هي الصيغة التجريبية لأكسيد البورون؟
ج: الصيغة التجريبية لأكسيد البوريك هي B2O3.
س: متى يؤثر تركيز البورون السطحي على معدل نمو الأكسيد؟
ج: سيؤثر التركيز السطحي للبورون على معدل نمو الأكسيد عندما يعمل كمنشط أو محفز في عملية الأكسدة.
س: ما هو أكسيد بوريا البورون؟
ج: أكسيد البوريك، المعروف أيضًا باسم البوريا، هو مركب صيغته الكيميائية B2O3.
س: ما هو عدد تأكسد البورون؟
ج: يحتوي البورون عمومًا على عدد تأكسد قدره +3.
س: هل يبطئ البورون عملية الأكسدة في المواد المحرومة من الأكسجين؟
ج: لا يبطئ البورون الأكسدة في المواد المحرومة من الأكسجين لأنه يحتاج إلى الأكسجين لتكوين أكسيد البوريك.
س: ما هي حالة أكسدة البورون في HBO2 في CuO؟
ج: حالة أكسدة البورون في HBO2 هي +3.
س: ما عدد مولات B2O3 التي يمكن تكوينها؟
ج: يعتمد عدد مولات B2O3 المتكونة على كمية المواد المتفاعلة المستخدمة في التفاعل.
س: هل B2O3 أيوني أم جزيئي؟
ج: B2O3 مركب أيوني.
س: ما هو الزوج الذي تم ترتيبه حسب زيادة الأساسية؟ PBO <SiO2 B2O3 <Li2O
ج: الزوج المدرج حسب الترتيب الأساسي المتزايد هو B2O3 < Li2O < PBO < SiO2.
س: B2H6 + O2 → B2O3 + H2O، هل هذه المعادلة متوازنة؟
ج: لا، المعادلة غير متوازنة. وهذا يتطلب تعديلات لتحقيق معادلة متوازنة.
س: ما هي كمية البورون التي يمكنك الحصول عليها من 210.0 رطل من B2O3؟
ج: تعتمد كمية البورون التي يتم الحصول عليها من 210.0 رطل من B2O3 على الكتلة المولية وقياس العناصر الكيميائية للتفاعل.
