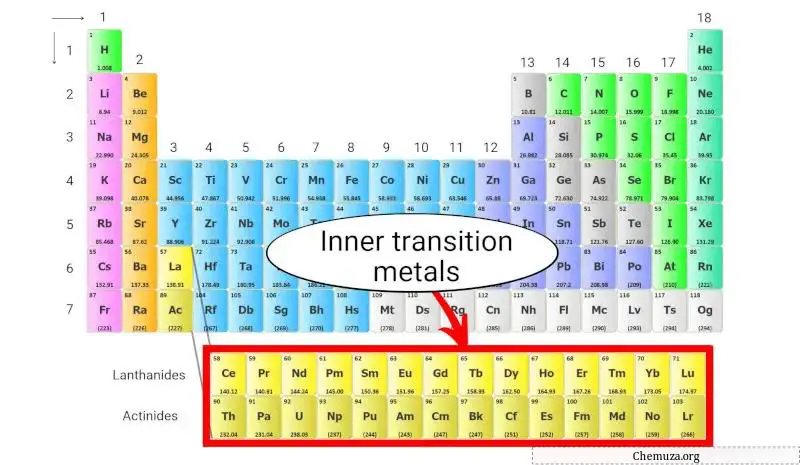
الفلزات الانتقالية الداخلية هي مجموعة من العناصر الكيميائية الموجودة في الصفين السفليين من الجدول الدوري ، أسفل الكتلة المعدنية الانتقالية الرئيسية مباشرة.
تنقسم الفلزات الانتقالية الداخلية إلى مجموعتين:
- اللانثانيدات ، التي يتراوح عددها الذري من 57 إلى 71، و
- الأكتينيدات ، التي يتراوح عددها الذري من 89 إلى 103.
دعونا نستكشف المزيد من عناصر الانتقال الداخلي في الجدول الدوري.
ما هي المعادن الانتقالية الداخلية؟ ولماذا يتم وضعها في الأسفل؟
تشكل المعادن الانتقالية الداخلية مجموعة العناصر الموجودة في أسفل الجدول الدوري.
هذه المعادن الانتقالية الداخلية ليست سوى جزء من المعادن الانتقالية ولها أيضًا خصائص مشابهة للمعادن الانتقالية. ولكن يتم وضعها في القسم الداخلي كامتداد للمجموعة 3.
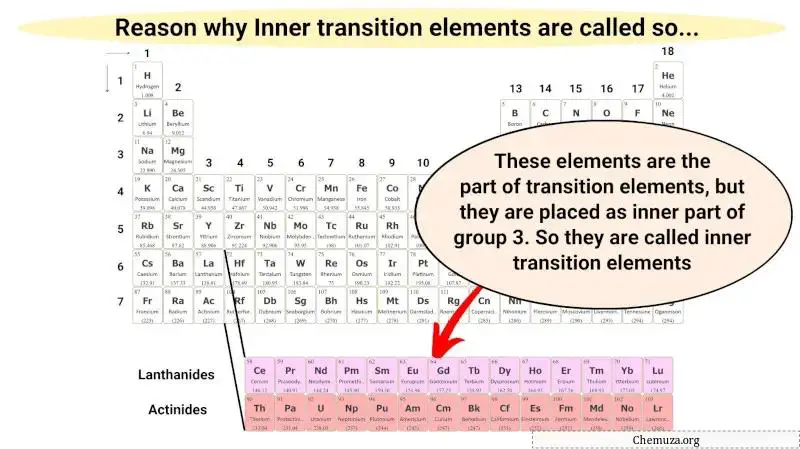
ولذلك تسمى هذه العناصر المعدنية بالمعادن الانتقالية الداخلية.
ولماذا يتم وضعها في أسفل الجدول الدوري؟
إذا تم وضع الفلزات الانتقالية الداخلية كامتداد للمجموعة 3، فسيظهر الجدول الدوري طويلًا جدًا (كما هو موضح أدناه).

لذا، من أجل وضعها على ورق بحجم A4، يتم وضع صفين من المعادن الانتقالية الداخلية في الأسفل.
علاوة على ذلك، فإن هذه العناصر الانتقالية الداخلية لها إلكترونات التكافؤ الخاصة بها في المدار f ، مما يجعل هذه العناصر لها خواص كيميائية مماثلة.
ولهذه الأسباب يتم وضع الفلزات الانتقالية الداخلية في أسفل الجدول الدوري.
قائمة المعادن الانتقالية الداخلية
قائمة المعادن الانتقالية الداخلية موضحة أدناه.
| العدد الذري | رمز | اسم العنصر والرمز |
| 57 | هناك | اللانثانم |
| 58 | هذا | السيريوم |
| 59 | العلاقات العامة | براسيوديميوم |
| 60 | SD | النيوديميوم |
| 61 | مساءً | البروميثيوم |
| 62 | قليل | سماريوم |
| 63 | نحن | اليوروبيوم |
| 64 | إله | الجادولينيوم |
| 65 | مرض الدرن | تيربيوم |
| 66 | دي | الديسبروسيوم |
| 67 | هو | الهولميوم |
| 68 | أوه | الإربيوم |
| 69 | TM | الثوليوم |
| 70 | نعم | الإيتربيوم |
| 71 | يقرأ | اللوتيتيوم |
| 89 | مكيف الهواء | الأكتينيوم |
| 90 | ذ | الثوريوم |
| 91 | بنسلفانيا | البروتكتينيوم |
| 92 | ش | اليورانيوم |
| 93 | نب | النبتونيوم |
| 94 | استطاع | البلوتونيوم |
| 95 | أكون | الأمريسيوم |
| 96 | سم | الكوريوم |
| 97 | ك. | البركيليوم |
| 98 | يرى | كاليفورنيا |
| 99 | يكون | اينشتاينيوم |
| 100 | FM | الفرميوم |
| 101 | ميريلاند | مندليفيوم |
| 102 | لا | نوبليوم |
| 103 | L/R | لورانس |
حقائق عن المعادن الانتقالية الداخلية
فيما يلي بعض الحقائق المثيرة للاهتمام حول المعادن الانتقالية الداخلية:
- هناك نوعان من الفلزات الانتقالية الداخلية: اللانثانيدات والأكتينيدات. اللانثانيدات هي العناصر الخمسة عشر التي يتراوح عددها الذري من 57 ( اللانثانم ) إلى 71 ( اللوتيتيوم )، في حين أن الأكتينيدات هي العناصر الخمسة عشر التي يتراوح عددها الذري من 89 ( الأكتينيوم ) إلى 103 ( اللورنسيوم ).
- تتمتع المعادن الانتقالية الداخلية بتكوينات إلكترونية فريدة بسبب وجود المدارات f. وينتج عن هذا خواص كيميائية وفيزيائية غير عادية، مثل درجات الانصهار والغليان العالية، وتكوين الأيونات المعقدة، والمغناطيسية المسايرة.
- معظم الفلزات الانتقالية الداخلية مشعة وقد تم استخدام بعضها في المفاعلات والأسلحة النووية.
- المعادن الانتقالية الداخلية مهمة في التكنولوجيا والصناعة. على سبيل المثال، يتم استخدام النيوديميوم والسماريوم لصنع مغناطيسات قوية [1] ويستخدم السيريوم في المحولات الحفازة لتقليل انبعاثات المركبات. [2]
- يُطلق على اللانثانيدات أيضًا اسم “العناصر الأرضية النادرة” لأنها نادرة نسبيًا في القشرة الأرضية. ومع ذلك، فهي ليست نادرة في الواقع وتوجد في العديد من المعادن.
- الأكتينيدات كلها مشعة وبعضها، مثل اليورانيوم والبلوتونيوم ، مهم للطاقة النووية والأسلحة. ومع ذلك، فإنها تشكل أيضًا مخاطر بيئية وصحية بسبب نشاطها الإشعاعي.
- عرفت المعادن الانتقالية الداخلية منذ القدم، وكانت تستخدم في صناعة المجوهرات والديكور. ومع ذلك، لم تتم دراستها أو فهمها على نطاق واسع حتى القرن العشرين .
خصائص المعادن الانتقالية الداخلية
فيما يلي بعض خصائص المعادن الانتقالية الداخلية:
- التكوين الإلكتروني: تمتلئ الفلزات الانتقالية الداخلية بمدارات f جزئيًا، مما يمنحها تكوينًا إلكترونيًا فريدًا وخصائص كيميائية وفيزيائية غير عادية.
- نقاط انصهار وغليان عالية: تتمتع الفلزات الانتقالية الداخلية بنقاط انصهار وغليان عالية بسبب الترابط المعدني القوي الناتج عن وجود إلكترونات غير متزاوجة في المدارات f.
- بارامغناطيسية: المعادن الانتقالية الداخلية هي مغناطيسية، مما يعني أنها تنجذب إلى المجال المغناطيسي بسبب وجود إلكترونات غير متزاوجة في المدارات f.
- تكوين الأيونات المعقدة: يمكن للمعادن الانتقالية الداخلية أن تشكل أيونات معقدة بسبب توفر مدارات f فارغة، والتي يمكن أن تستوعب إلكترونات من ذرات أو جزيئات أخرى.
- النشاط الإشعاعي: العديد من الفلزات الانتقالية الداخلية مشعة بسبب وجود نظائر غير مستقرة في نواتها.
- حالات الأكسدة: تظهر المعادن الانتقالية الداخلية مجموعة من حالات الأكسدة، بما في ذلك حالات الأكسدة العالية، بسبب توفر إلكترونات التكافؤ المتعددة في المدارات f.
- خصائص كيميائية مماثلة: اللانثانيدات والأكتينيدات لها خصائص كيميائية مماثلة، مما يجعل من الصعب فصلها عن بعضها البعض.
- اللمعان المعدني: المعادن الانتقالية الداخلية تكون بشكل عام لامعة ولها لمعان معدني بسبب انعكاسها العالي للضوء.
استخدامات المعادن الانتقالية الداخلية
تتمتع المعادن الانتقالية الداخلية بمجموعة واسعة من الاستخدامات نظرًا لخصائصها الفريدة. بعض استخدامات المعادن الانتقالية الداخلية هي:
- الطاقة النووية: يتم استخدام العديد من المعادن الانتقالية الداخلية، وخاصة الأكتينيدات مثل اليورانيوم، كوقود للمفاعلات والأسلحة النووية.
- المغناطيس: يتم استخدام اللانثانيدات مثل النيوديميوم، والسماريوم، والجادولينيوم لصنع مغناطيسات قوية لمجموعة متنوعة من التطبيقات، بما في ذلك محركات الأقراص الصلبة للكمبيوتر، وتوربينات الرياح، وأجهزة التصوير بالرنين المغناطيسي.
- الإضاءة: يتم استخدام اللانثانيدات مثل اليوروبيوم والتيربيوم لصنع الفوسفور لإضاءة الفلورسنت وLED. [3]
- التحفيز: تستخدم اللانثانيدات مثل السيريوم كمحفزات في العديد من العمليات الصناعية، بما في ذلك تكرير البترول ومكافحة التلوث.
- صناعة الزجاج: يستخدم اللانثانيدات مثل الإربيوم والإيتربيوم لتلوين الزجاج، بينما يستخدم السيريوم لتلميع الزجاج.
- التصوير الطبي: تُستخدم اللانثانيدات مثل الجادولينيوم والتيربيوم في عوامل التباين في فحوصات التصوير بالرنين المغناطيسي. [4]
- الإلكترونيات: تُستخدم اللانثانيدات مثل الديسبروسيوم والتيربيوم في الأجهزة الإلكترونية، مثل مرشحات الميكروويف وشاشات LCD.
- الدفاع: تستخدم المعادن الانتقالية الداخلية في تقنيات الدفاع، بما في ذلك الأسلحة النووية والذخائر الخارقة للدروع.
ملخص
المعادن الانتقالية الداخلية هي مجموعة من العناصر الكيميائية الموجودة في الصفين السفليين من الجدول الدوري، أسفل الكتلة المعدنية الانتقالية الرئيسية مباشرةً.
وهي مقسمة إلى مجموعتين: اللانثانيدات والأكتينيدات، والتي يتراوح عددها الذري من 57 إلى 71 ومن 89 إلى 103 على التوالي.
يقع موقع المعادن الانتقالية الداخلية في أسفل الجدول الدوري لأن إلكترونات التكافؤ الخاصة بها موجودة في المدار f، الذي له خصائص كيميائية مماثلة.
تتميز الفلزات الانتقالية الداخلية بنقاط انصهار وغليان عالية، وتكوين أيوني معقد، ومغناطيسية مسايرة. كما أنها تظهر مجموعة من حالات الأكسدة، بما في ذلك حالات الأكسدة العالية، بسبب توفر إلكترونات التكافؤ المتعددة في المدارات f.
