أوكسي كلوريد الفوسفور (POCl3) هو مركب كيميائي يستخدم في العمليات الصناعية المختلفة. يتفاعل مع الماء لتكوين حمض الفوسفوريك وحمض الهيدروكلوريك.
| اسم الأيوباك | أوكسي كلوريد الفوسفور |
| الصيغة الجزيئية | POCl3 |
| CAS رقم | 10025-87-3 |
| المرادفات | كلوريد الفوسفوريل، ثلاثي كلوريد الفوسفوريل، ثلاثي كلوريد الفوسفور |
| إنتشي | InChI=1S/Cl3OP/c1-4(2)3 |
خصائص أوكسي كلوريد الفوسفور
صيغة أوكسي كلوريد الفوسفور
الصيغة الكيميائية لكلوريد الفوسفوريل هي POCl3. ويتكون من ذرة فوسفور واحدة (P) يرمز لها بالرمز P، وثلاث ذرات كلور (Cl) يرمز لها بالرمز Cl، وتشير الصيغة إلى نسبة كل عنصر موجود في المركب.
الكتلة المولية لأوكسي كلوريد الفوسفور
يمكن حساب الكتلة المولية لكلوريد الفوسفوريل عن طريق إضافة الكتل الذرية للعناصر المكونة له. يمتلك الفوسفور كتلة مولية قدرها 30.97 جم/مول، بينما تبلغ الكتلة المولية للكلور 35.45 جم/مول. ضرب الكتلة المولية للكلور في 3 وإضافة الكتلة المولية للفوسفور يعطي كتلة مولية إجمالية تبلغ حوالي 153.33 جم / مول لكلوريد الفوسفوريل.
نقطة غليان أوكسي كلوريد الفوسفور
كلوريد الفوسفوريل لديه نقطة غليان تبلغ حوالي 105.5 درجة مئوية. تمثل درجة الحرارة هذه النقطة التي يتحول عندها المركب السائل إلى الحالة الغازية تحت الضغط الجوي القياسي. تعتبر نقطة الغليان من الخصائص المهمة التي تؤثر على معالجة وتطبيق كلوريد الفسفوريل.
نقطة انصهار أوكسي كلوريد الفوسفور
تبلغ نقطة انصهار كلوريد الفوسفوريل حوالي -112.5 درجة مئوية. وهذا يعني درجة الحرارة التي يتحول عندها المركب الصلب إلى الحالة السائلة. تعتبر نقطة الانصهار معلمة حاسمة لاعتبارات التخزين والنقل.
كثافة أوكسي كلوريد الفوسفور جم/مل
تبلغ كثافة كلوريد الفوسفوريل حوالي 1.65 جم / مل. تشير الكثافة إلى مقدار الكتلة لكل وحدة حجم من المادة. تشير الكثافة الأعلى إلى تركيز أكبر للجزيئات في حجم معين.
الوزن الجزيئي لأوكسي كلوريد الفوسفور
يتم حساب الوزن الجزيئي لكلوريد الفوسفوريل عن طريق إضافة الكتل الذرية للعناصر المكونة له. يبلغ الوزن الجزيئي للفوسفور حوالي 30.97 جم/مول، بينما يبلغ الوزن الجزيئي للكلور 35.45 جم/مول. إن إضافة الكتل الموزونة يعطي وزنًا جزيئيًا تقريبيًا قدره 153.33 جم/مول لكلوريد الفوسفوريل.
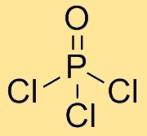
هيكل أوكسي كلوريد الفوسفور
يحتوي كلوريد الفوسفوريل على بنية جزيئية ترتبط فيها ذرة فوسفور واحدة بثلاث ذرات كلور وذرة أكسجين واحدة. يتم ترتيب ذرات الكلور بشكل متناظر حول ذرة الفسفور المركزية، مع ذرة الأكسجين أيضًا المرتبطة بذرة الفسفور. يشكل هذا الترتيب هندسة رباعية السطوح.
ذوبان أوكسي كلوريد الفوسفور
كلوريد الفوسفوريل قليل الذوبان في الماء ولكنه يذوب بسهولة في المذيبات العضوية مثل البنزين ورابع كلوريد الكربون والكلوروفورم. ويعزى سلوك ذوبانه إلى الطبيعة القطبية للجزيء ووجود ذرات سالبية كهربية مثل الأكسجين والكلور.
| مظهر | سائل عديم اللون |
| جاذبية معينة | 1,645 جم/مل |
| لون | عديم اللون |
| يشم | فدان |
| الكتلة المولية | 153.33 جرام/مول |
| كثافة | 1,645 جم/مل |
| نقطة الانصهار | -112.5 درجة مئوية |
| نقطة الغليان | 105.5 درجة مئوية |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | يتفاعل بقوة |
| الذوبان | قابل للذوبان في المذيبات العضوية مثل البنزين ورابع كلوريد الكربون والكلوروفورم |
| ضغط البخار | 11 ملم زئبق عند 20 درجة مئوية |
| كثافة بخار | 5.29 (الهواء = 1) |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | غير قابل للتطبيق |
السلامة ومخاطر أوكسي كلوريد الفوسفور
يشكل كلوريد الفوسفوريل مخاطر على السلامة ويتطلب معالجة دقيقة. وهو يسبب تآكل الجلد والعينين والجهاز التنفسي. الاتصال قد يسبب حروقا شديدة وتلف العين. استنشاق الأبخرة أو الأبخرة يمكن أن يهيج الجهاز التنفسي. يجب ارتداء معدات الحماية الشخصية المناسبة، مثل القفازات والنظارات الواقية، عند العمل مع هذا المركب. يجب أن يتم تخزينه في منطقة جيدة التهوية، بعيدا عن مصادر الاشتعال. في حالة التعرض لها، من الضروري الحصول على عناية طبية فورية. وبالإضافة إلى ذلك، يجب التعامل معها تحت غطاء الدخان لتجنب إطلاق الأبخرة السامة.
| رموز الخطر | تآكل، خطر |
| وصف الأمان | تآكل. يسبب حروقا جلدية شديدة وتلفا للعين. قد يكون ضارًا إذا تم استنشاقه أو ابتلاعه. تجنب الاتصال والاستنشاق. |
| أرقام تعريف الأمم المتحدة | أ 1810 |
| رمز النظام المنسق | 2812.10.00 |
| فئة الخطر | الفئة 8 (المواد المسببة للتآكل) |
| مجموعة التعبئة | مجموعة التعبئة III (خطر طفيف) |
| تسمم | كلوريد الفوسفوريل سام ويمكن أن يسبب آثارًا صحية خطيرة. |
طرق تصنيع أوكسي كلوريد الفوسفور
يمكن تصنيع كلوريد الفوسفوريل بطرق مختلفة. تتضمن الطريقة الشائعة التفاعل بين ثلاثي كلوريد الفوسفور (PCl3) والأكسجين (O2). في هذه العملية، يتم تسخين PCl3 في وجود الأكسجين الزائد لتكوين كلوريد الفسفوريل. يكون التفاعل طاردًا للحرارة ويحدث عادةً في بيئة خاضعة للرقابة، مثل وعاء المفاعل.
تتضمن طريقة التخليق الأخرى التفاعل بين خامس أكسيد الفوسفور (P2O5) وثلاثي كلوريد الفوسفور. يعمل P2O5 كعامل تجفيف، وعندما يتحد مع PCl3 فإنه يشكل كلوريد الفسفوريل.
بالإضافة إلى ذلك، يمكن تصنيع كلوريد الفوسفوريل عن طريق تفاعل ثلاثي بروميد الفوسفور (PBr3) وخامس أكسيد الفوسفور. يؤدي هذا التفاعل إلى تكوين كلوريد الفسفوريل وخماسي بروميد الفوسفور.
بالإضافة إلى ذلك، يمكن أن تؤدي الكلورة المباشرة للفوسفور أيضًا إلى إنتاج كلوريد الفوسفوريل. وفي هذه العملية، يمر غاز الكلور فوق الفوسفور الساخن، مما يؤدي إلى تكوين كلوريد الفسفوريل.
ومن المهم أن نلاحظ أن هذه الأساليب الاصطناعية يجب أن يتم تنفيذها بحذر بسبب التفاعل والطبيعة الخطرة للمركبات المعنية. يجب اتباع بروتوكولات السلامة المناسبة، بما في ذلك استخدام معدات الحماية وظروف التفاعل الخاضعة للرقابة، لضمان التعامل الآمن مع كلوريد الفسفوريل وتوليفه.
استخدامات أوكسي كلوريد الفوسفور
يجد كلوريد الفوسفوريل تطبيقات مختلفة في صناعات مختلفة بسبب خصائصه الفريدة. فيما يلي بعض الاستخدامات الشائعة:
- التخليق الكيميائي: تستخدم الكيمياء العضوية على نطاق واسع كلوريد الفوسفوريل ككاشف متعدد الاستخدامات لإنتاج مركبات مختلفة، بما في ذلك أحماض الفوسفونيك والإسترات والأميدات.
- الكيماويات الزراعية: يرتبط تصنيع المبيدات الحشرية ومبيدات الأعشاب في حماية المحاصيل ومكافحة الآفات بكلوريد الفوسفوريل كمكون رئيسي، ويلعب دورًا حاسمًا.
- صناعة الأدوية: يستخدم تصنيع الوسطيات الصيدلانية والمكونات الصيدلانية النشطة (APIs) كلوريد الفوسفوريل، مما يسهل تصنيع الأدوية المهمة مثل الأدوية المضادة للملاريا والمضادة للالتهابات.
- صناعة البوليمر: في إنتاج البوليمر، يعمل كلوريد الفوسفوريل كعامل محفز وعامل كلورة، مما يساهم في تخليق إضافات مثبطات اللهب التي تعمل على تحسين مقاومة المواد للحريق.
- صناعة الأصباغ والأصباغ: يستخدم كلوريد الفوسفوريل في إنتاج الأصباغ والأصباغ، وخاصة في تحضير فوسفونات الكلوروالكيل، وهي مركبات ضرورية لتطوير الأصباغ المستخدمة في المنسوجات والأحبار والطلاءات.
- الكاشف المعملي: تستخدم الإجراءات المخبرية المختلفة كلوريد الفسفوريل ككاشف، بما في ذلك تحويل الكحولات إلى كلوريدات الألكيل وتحضير عوامل الفسفرة.
- معالجة المياه: تستخدم عمليات معالجة المياه كلوريد الفوسفوريل كعامل محمض ومطهر للتحكم في مستويات الرقم الهيدروجيني وإزالة الشوائب.
- مثبطات اللهب: يلعب كلوريد الفوسفوريل دورًا في إنتاج المواد المثبطة للهب، مما يحسن خصائص السلامة من الحرائق للمنسوجات والبلاستيك ومواد البناء.
توضح هذه التطبيقات المتنوعة أهمية كلوريد الفوسفوريل في العديد من القطاعات الصناعية، مما يسلط الضوء على دوره الحاسم في التخليق الكيميائي والزراعة والمستحضرات الصيدلانية وعلوم المواد.
أسئلة
س: ما هي الهندسة الجزيئية لـ POCl3؟
ج: الهندسة الجزيئية لـ POCl3 هي هرمية مثلثية.
س: ما هو الألكين الرئيسي الذي يتكون عند تجفيف المركب A باستخدام POCl3 والبيريدين؟
ج: الألكين الرئيسي الذي يتكون أثناء تجفيف المركب A مع POCl3 والبيريدين يعتمد على البنية المحددة للمركب A.
س: هل POCl3 قطبي أم غير قطبي؟
ج: POCl3 هو جزيء قطبي بسبب وجود روابط قطبية وشكل جزيئي غير متماثل.
س: ما هي كمية غاز POCl3 التي يمكن إنتاجها؟
ج: يعتمد حجم غاز POCl3 الناتج على كميات المواد المتفاعلة وظروف التفاعل المحددة.
س: ما عدد مولات POCl3 الموجودة في 10.0 جرام من POCl3؟
ج: يوجد ما يقرب من 0.082 مول من POCl3 في 10.0 جرام من POCl3.
س: ما هي هندسة زوج الإلكترون لـ P في POCl3؟
ج: إن هندسة زوج الإلكترونات لـ P في POCl3 هي رباعية السطوح.
س: هل يحتوي POCl3 على عزم ثنائي القطب؟
ج: نعم، يتمتع POCl3 بعزم ثنائي القطب بسبب وجود الروابط القطبية وهندسته الجزيئية.
س: هل POCl3 له صدى؟
ج: لا، لا يُظهر POCl3 رنينًا لأنه لا يوجد إلكترونات غير متمركزة أو هياكل رنين متعددة.
س: ما هي هندسة المجال الإلكتروني حول ذرة الأكسجين في POCl3؟
ج: إن هندسة المجال الإلكتروني حول ذرة الأكسجين في POCl3 هي هرمية مثلثية.
س: ما حجم H3PO4 الذي سيتشكل عندما يتفاعل 72.3 ملليلتر من POCl3 بشكل كامل؟
ج: يعتمد حجم H3PO4 المتكون عندما يتفاعل 72.3 ملليلتر من POCl3 بشكل كامل على قياس العناصر الكيميائية للتفاعل ولا يمكن تحديده بناءً على المعلومات المقدمة وحدها.
