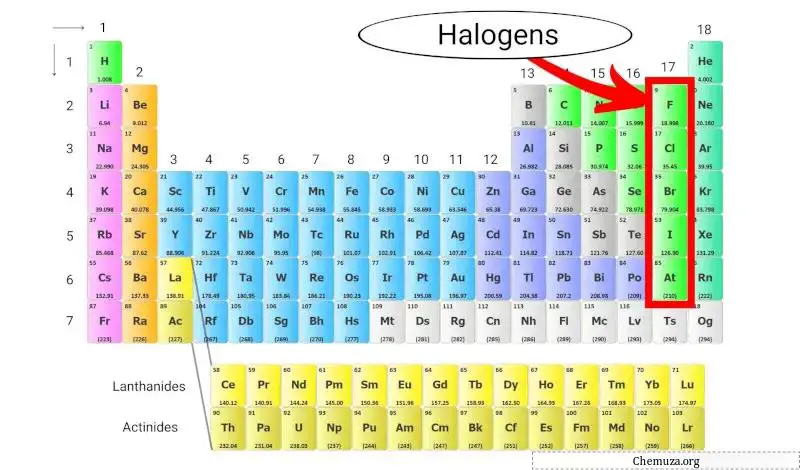
الهالوجينات هي مجموعة من العناصر الموجودة في المجموعة 17 (وتسمى أيضًا مجموعة الهالوجين) من الجدول الدوري . تشتمل الهالوجينات على خمسة عناصر مختلفة: الفلور (F)، الكلور (Cl)، البروم (Br)، اليود (I)، والأستاتين (At).
الهالوجينات فريدة من نوعها لأنها المجموعة الوحيدة من العناصر القادرة على تكوين مركبات مع جميع العناصر الأخرى في الجدول الدوري.
دعونا نستكشف الهالوجينات بشكل أكبر.
ما هي الهالوجينات؟ ولماذا يطلق عليهم ذلك؟
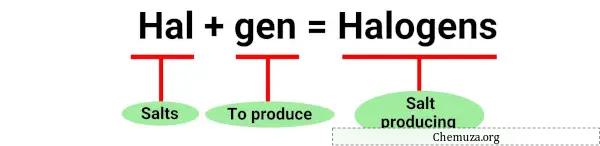
مصطلح “الهالوجين” مشتق من الكلمات اليونانية “halos” التي تعني الملح و”الجينات” التي تعني المنتج. [1]
وبالفعل، تم اكتشاف الهالوجينات لأول مرة من خلال قدرتها على إنتاج الأملاح عند التفاعل مع المعادن .
على سبيل المثال:
عندما يتفاعل الكلور (Cl 2 ) مع الصوديوم (Na)، فإنه يشكل كلوريد الصوديوم (NaCl)، وهو ملح الطعام الشائع:
2Na + Cl2 → 2NaCl
وبالمثل، عندما يتفاعل البروم ( Br2 ) مع البوتاسيوم (K)، فإنه يشكل بروميد البوتاسيوم (KBr):
2K + Br2 → 2KBr
هذه التفاعلات هي أمثلة على الهالوجينات التي تنتج الأملاح عندما تتفاعل مع المعادن، ومن هنا جاء اسم “الهالوجين”.
الهالوجين الأكثر تفاعلاً في الجدول الدوري
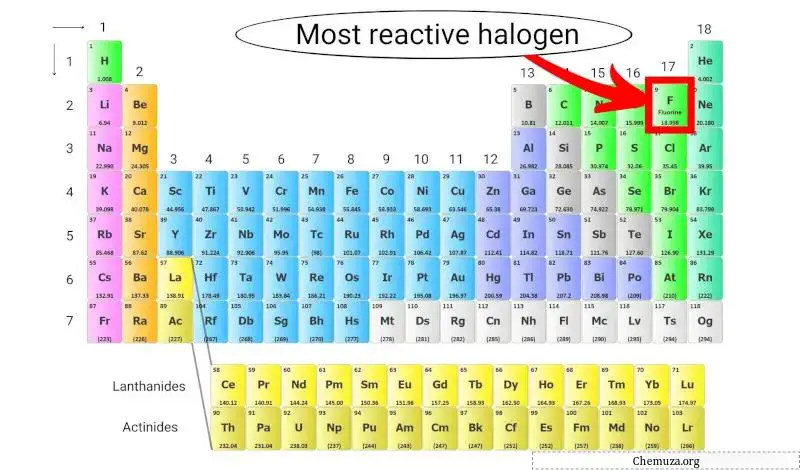
الفلور هو الهالوجين الأكثر تفاعلاً لأنه يمتلك أعلى السالبية الكهربية بين جميع العناصر الموجودة في الجدول الدوري، مما يعني أنه يتمتع بجاذبية قوية للإلكترونات.
وهذا يجعله شديد التفاعل وقادرًا على التفاعل مع كل العناصر الأخرى تقريبًا في الجدول الدوري لتكوين مركبات. [2]
ببساطة، الفلور يشبه مغناطيس للإلكترونات وسيبذل كل ما في وسعه لاكتساب إلكترون واستكمال غلافه الخارجي.
ويقوم بذلك عن طريق التفاعل مع العناصر الأخرى وسرقة إلكتروناتها لتكوين مركبات جديدة.
ولهذا السبب يكون الفلور شديد التفاعل، ولهذا السبب لا يوجد أبدًا في شكله العنصري في الطبيعة، ولكنه يوجد دائمًا كمركب.
نظرًا لتفاعله العالي، يعد الفلورايد أيضًا خطيرًا للغاية ويمكن أن يكون غير آمن للاستخدام.
غالبًا ما يتم التعامل معه في مختبرات متخصصة ويستخدم في العمليات الصناعية لإنتاج مجموعة واسعة من المواد الكيميائية والمواد.
تفاعل الهالوجينات
الهالوجينات شديدة التفاعل بسبب ارتفاع سالبيتها الكهربية، مما يعني أن لديها قدرة عالية جدًا على جذب الإلكترونات.
بالإضافة إلى ذلك، تحتوي الهالوجينات على 7 إلكترونات في غلافها الخارجي، وتحتاج فقط إلى إلكترون واحد إضافي لملئها والوصول إلى تكوين إلكتروني مستقر مثل الغازات النبيلة .
على سبيل المثال، يمكنك أن ترى أن مخطط بور للفلور يحتوي على 7 إلكترونات في غلافه الخارجي.
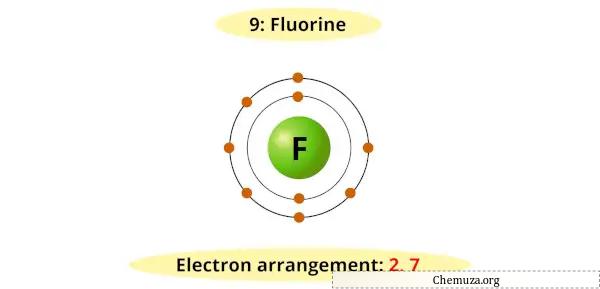
يتطلب الأمر الآن إلكترونًا إضافيًا واحدًا للحصول على ثماني بتات مستقرة (7 + 1 = 8).
تتفاعل الهالوجينات مع المعادن لتكوين مركبات أيونية تسمى الهاليدات المعدنية ، والتي يمكن أن تنتج لهبًا ساطعًا وملونًا.
كما أنها تتفاعل مع اللافلزات مثل الهيدروجين والكبريت والنيتروجين لتكوين مجموعة من المركبات التساهمية. [3]
ولذلك فإن ميل الهالوجينات لاكتساب إلكترون والحصول على تكوين مستقر للغازات النبيلة يجعلها شديدة التفاعل وقادرة على تكوين مركبات مع عناصر أخرى.
اتجاهات الهالوجين الدورية
عندما ننتقل إلى أسفل المجموعة، تظهر عناصر الهالوجين تغيرات في خواصها الفيزيائية بالإضافة إلى خواصها الكيميائية.
دعونا نلقي نظرة على الاتجاهات في بعض خصائص الهالوجينات.
- الحجم الذري: كلما نزولنا إلى أسفل المجموعة، يزداد الحجم الذري للهالوجينات. وذلك لأن كل هالوجين لديه مستوى طاقة أكثر من المستوى الذي فوقه، مما يعني أن الإلكترونات الخارجية بعيدة عن النواة.
- السالبية الكهربية: عندما يتحرك الفرد إلى أسفل المجموعة، تقل السالبية الكهربية لعناصر الهالوجين. وهذا يعني أن الهالوجينات الموجودة في الجزء العلوي من المجموعة، مثل الفلور والكلور، أكثر سالبية كهربية وبالتالي أكثر عرضة لجذب الإلكترونات من تلك الموجودة في الجزء السفلي، مثل اليود والأستاتين.
- نقاط الانصهار ونقاط الغليان: كلما تحرك الشخص إلى أسفل المجموعة، تزداد نقاط انصهار وغليان الهالوجينات. في الواقع، تحتوي الذرات الأكبر حجمًا على عدد أكبر من الإلكترونات وتكون قادرة على تكوين قوى بين الجزيئات أقوى. [4]
- التفاعلية تجاه المعادن: كلما تحرك الشخص إلى أسفل المجموعة، تقل تفاعلية الهالوجينات تجاه المعادن. وهذا يعني أن الهالوجينات الموجودة في الجزء العلوي من المجموعة، مثل الفلور والكلور، من المرجح أن تتفاعل مع المعادن أكثر من تلك الموجودة في الجزء السفلي، مثل اليود والأستاتين.
ملخص
الهالوجينات هي مجموعة من خمسة عناصر (الفلور، الكلور، البروم، اليود والأستاتين) موجودة في المجموعة 17 من الجدول الدوري. فهي فريدة من نوعها في قدرتها على تكوين مركبات مع جميع العناصر الأخرى.
الهالوجينات شديدة التفاعل بسبب سالبيتها الكهربية العالية وميلها إلى اكتساب إلكترون لتحقيق تكوين مستقر للغازات النبيلة. الفلور هو الهالوجين الأكثر تفاعلاً بسبب كهروسلبيته العالية.
عندما يتحرك الشخص إلى أسفل المجموعة، تظهر الهالوجينات تغيرات في خواصها الفيزيائية والكيميائية، مثل زيادة الحجم الذري، وانخفاض السالبية الكهربية، وزيادة في درجات الانصهار والغليان. كما أن تفاعل الهالوجينات تجاه المعادن يتناقص أيضًا كلما تحرك الفرد إلى أسفل المجموعة.
