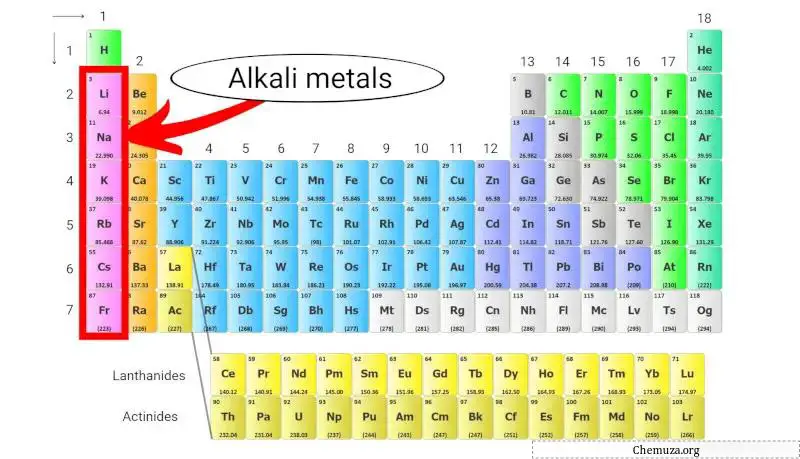
الفلزات القلوية هي مجموعة من العناصر الكيميائية الموجودة في العمود الأول من الجدول الدوري . وتشمل هذه المجموعة الليثيوم والصوديوم والبوتاسيوم والروبيديوم والسيزيوم والفرانسيوم .
الفلزات القلوية لينة ولها درجات انصهار وغليان منخفضة. وهي تستخدم عادة في البطاريات والسبائك والتفاعلات الكيميائية المختلفة.
دعونا نستكشف المزيد عن الفلزات القلوية في الجدول الدوري.
ما هي المعادن القلوية؟

الفلزات القلوية هي مجموعة من العناصر الكيميائية في الجدول الدوري تنتمي إلى المجموعة 1 .
وتتميز هذه العناصر بنعومتها ونقاط انصهارها المنخفضة وتفاعليتها العالية وقدرتها على تكوين محاليل قلوية عند التفاعل مع الماء.
بعض الخصائص الرئيسية للمعادن القلوية تشمل:
- لديهم سالبية كهربية وطاقات تأين منخفضة، مما يعني أنها تميل إلى فقدان الإلكترونات بسهولة وتكوين الكاتيونات.
- تتميز بنقاط انصهار وغليان منخفضة، مما يجعلها ناعمة نسبيًا وسهلة الذوبان.
- لديهم تفاعل عالي مع الماء والأكسجين، مما يجعلها تتفاعل في الهواء والماء.
- فهي موصلة جيدة للحرارة والكهرباء.
لماذا سميت الفلزات القلوية بهذا الاسم؟

تسمى الفلزات القلوية بهذا الاسم لأنها قادرة على تكوين محاليل قلوية قوية (قاعدية) عندما تتفاعل مع الماء. [1]
عندما تتلامس هذه المعادن مع الماء، فإنها تطلق غاز الهيدروجين وتشكل أيونات الهيدروكسيد، والتي تعطي المحلول الرقم الهيدروجيني الأساسي .
توضيح:
ترجع تفاعلية الفلزات القلوية مع الماء إلى انخفاض طاقات التأين فيها [2] ، مما يعني أنها قادرة على فقدان الإلكترونات بسهولة وتكوين أيونات موجبة (كاتيونات).
وعندما تتلامس مع الماء، فإنها تخضع لتفاعل كيميائي تفقد فيه الإلكترونات وتتفاعل مع جزيئات الماء لتكوين أيونات الهيدروكسيد وغاز الهيدروجين.
يطلق هذا التفاعل الكثير من الحرارة، مما قد يتسبب في اشتعال غاز الهيدروجين وانفجاره.
ترتيب تفاعل الفلزات القلوية
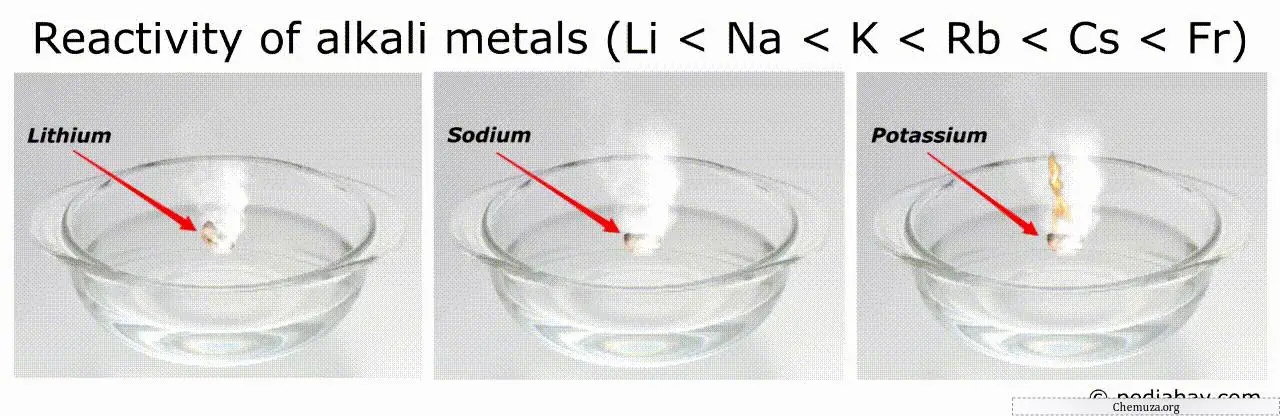
الاتجاه العام في ترتيب تفاعلية الفلزات القلوية هو أنها تزداد كلما انتقلنا إلى أسفل المجموعة من الليثيوم (Li) إلى الفرانسيوم (Fr).
وهذا يعني أن الفرانسيوم هو الأكثر تفاعلاً بين جميع الفلزات القلوية، في حين أن الليثيوم هو الأقل تفاعلاً.
والسبب في هذا الاتجاه هو أنه كلما تحرك الفرد إلى أسفل المجموعة، يزداد نصف القطر الذري للعناصر، بينما تنخفض طاقة التأين.
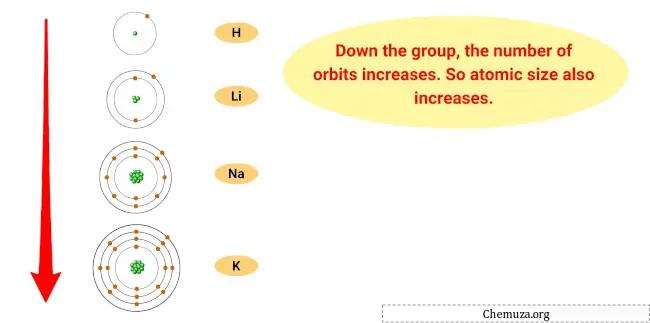
وهذا يعني أن الإلكترون الخارجي للذرات يكون أبعد عن النواة ويكون متماسكًا بشكل أقل إحكامًا، مما يسهل على العنصر أن يفقد هذا الإلكترون ويصبح كاتيونًا.
الفرانسيوم، كونه الأكبر والأقل ارتباطًا بالمجموعة، هو بالتالي الأكثر تفاعلاً.
هذا الترتيب من التفاعل له آثار مهمة على خصائص وسلوك الفلزات القلوية.
على سبيل المثال، يمكن للمعادن الأكثر تفاعلاً (مثل الفرانسيوم والسيزيوم) أن تشتعل تلقائيًا في الهواء أو الماء، مما يجعل التعامل معها خطيرًا للغاية.[3]
وعلى العكس من ذلك، فإن المعادن الأقل تفاعلاً (مثل الليثيوم) تكون أكثر استقرارًا ويمكن استخدامها في التطبيقات التي تتطلب معدنًا أكثر استقرارًا.
قائمة الفلزات القلوية وتكويناتها الإلكترونية
المعادن القلوية وتكويناتها الإلكترونية مبينة أدناه.
| عنصر | التكوين الإلكترونية |
| الليثيوم (لي) | [هو] 2س 1 |
| الصوديوم (نا) | [فعل] 3س 1 |
| البوتاسيوم (ك) | [ع] 4س 1 |
| الروبيديوم (Rb) | [كر] 5S 1 |
| السيزيوم (جيم) | [Xe] 6س 1 |
| الفرانسيوم (الاب) | [آر] 7س 1 |
الاتجاهات الدورية في المعادن القلوية
الاتجاهات الدورية للمعادن القلوية مذكورة أدناه:
- اتجاه التكافؤ: تكافؤ الفلزات القلوية هو دائمًا +1، مما يعني أنها تميل إلى فقدان إلكترون لتكوين كاتيون مستقر. وبالتالي لا يوجد أي تغيير في تكافؤ الفلزات القلوية عندما يتحرك الشخص إلى أسفل المجموعة. جميعهم لديهم نفس التكافؤ (أي 1).
- اتجاه الحجم الذري: يزداد الحجم الذري للفلزات القلوية كلما نزلت إلى أسفل المجموعة، مما يعني أن الذرات تصبح أكبر. وذلك لأنه كلما أضفت مستويات الطاقة، زاد حجم السحابة الإلكترونية.
- اتجاه الشخصية المعدنية: تزداد الشخصية المعدنية للمعادن القلوية كلما نزلت إلى أسفل المجموعة. وذلك لأن المعادن تصبح أكثر إيجابية كهربائيًا وتكون أكثر قدرة على التبرع بالإلكترونات لتكوين روابط معدنية.
- اتجاه السالبية الكهربية: تتناقص السالبية الكهربية للمعادن القلوية كلما نزلت إلى أسفل المجموعة. وذلك لأن الذرات تصبح أكبر والإلكترونات الخارجية أبعد عن النواة، فتقل انجذابها إليها.
- اتجاه الألفة الإلكترونية: يتناقص الألفة الإلكترونية للمعادن القلوية كلما نزلت إلى أسفل المجموعة. وبالفعل، في الجزء السفلي من المجموعة، يزداد حجم الذرات، مما يقلل من ميل الذرة لقبول الإلكترون. (اقرأ المزيد عن اتجاه تقارب الإلكترون هنا، للحصول على فهم تفصيلي).
- اتجاه طاقة التأين: تتناقص طاقة التأين للمعادن القلوية كلما نزلت إلى أسفل المجموعة. وهذا يعني أنه من الأسهل إزالة إلكترون من الغلاف الخارجي للذرة، لأن الإلكترونات بعيدة عن النواة وتكون أقل إحكامًا.
ملخص
الفلزات القلوية هي مجموعة من العناصر الكيميائية المعروفة بنعومتها، ونقطة انصهارها المنخفضة، وتفاعليتها العالية، وقدرتها على تكوين محاليل قلوية عند التفاعل مع الماء.
يزداد ترتيب تفاعل الفلزات القلوية كلما انتقلت إلى أسفل المجموعة من الليثيوم إلى الفرانسيوم بسبب زيادة نصف القطر الذري وانخفاض طاقة التأين.
تشمل الاتجاهات الدورية في الفلزات القلوية زيادة في الحجم الذري والشخصية المعدنية كلما تحرك الفرد إلى أسفل المجموعة، بالإضافة إلى انخفاض في السالبية الكهربية، والألفة الإلكترونية، وطاقة التأين.
يكون تكافؤ الفلزات القلوية دائمًا +1 وتتبع تكويناتها الإلكترونية نموذج [الغاز النبيل] ns 1 .
