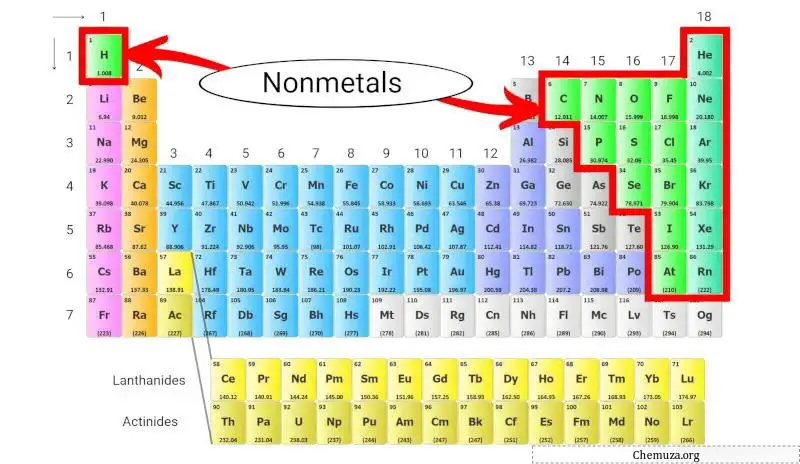
اللافلزات هي مجموعة من العناصر التي تفتقر إلى خصائص المعادن، مثل الموصلية الكهربائية العالية والبريق. وتقع هذه اللافلزات على الجانب الأيمن من الجدول الدوري ، باستثناء الهيدروجين .
يمكن العثور على اللافلزات في مجموعة متنوعة من الأشكال، بما في ذلك الغازات مثل الأكسجين والكلور والسوائل مثل البروم والمواد الصلبة مثل الكبريت والكربون . [1]
دعونا نرى أشياء أكثر أهمية حول المواد غير المعدنية.
ما هي بالضبط غير المعادن؟
اللافلزات هي عناصر تميل إلى اكتساب الإلكترونات أثناء التفاعلات الكيميائية، وتشكل أيونات أو أنيونات سالبة الشحنة.
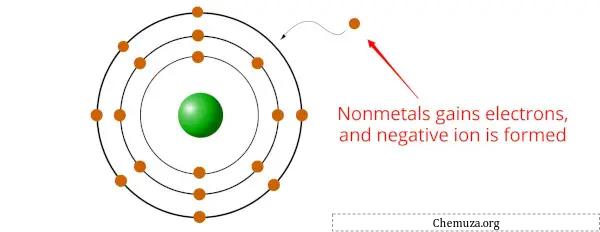
وذلك لأن اللافلزات تتمتع عمومًا بسالبية كهربية أعلى من المعادن، [2] مما يعني أن لديها جاذبية أكبر للإلكترونات.
عندما ترتبط اللافلزات بالمعادن ، يكتسب العنصر اللافلزى إلكترونًا واحدًا أو أكثر من المعدن لتكوين مركب مستقر.
على سبيل المثال، يكتسب الكلور إلكترونًا من الصوديوم لتكوين المركب الأيوني كلوريد الصوديوم (NaCl).
ويمكن القول أيضًا أن – اللافلزات هي مجموعة من العناصر الكيميائية التي لا تمتلك الخصائص الفيزيائية والكيميائية للمعادن.
حسنًا، دعونا نرى قائمة العناصر غير المعدنية الموجودة في الجدول الدوري.
قائمة العناصر غير المعدنية الموجودة في الجدول الدوري
فيما يلي قائمة باللافلزات الموجودة في الجدول الدوري:
- الهيدروجين (ح)
- هيليوم (هو)
- الكربون (ج)
- النيتروجين (ن)
- الأكسجين (س)
- فلوريت (F)
- نيون (ني)
- الفوسفور (ف)
- الكبريت (S)
- الكلور (الكلور)
- الأرجون (آر)
- السيلينيوم (سي)
- البروم (ر)
- الكريبتون (كر)
- اليود (أنا)
- زينون (Xe)
- أستاتين (في)
- الرادون (Rn)
وتقع هذه اللافلزات على الجانب الأيمن من الجدول الدوري، باستثناء الهيدروجين الذي يقع في أعلى الجدول الدوري فوق الفلزات القلوية .
حالة اللافلزات (صلبة أم سائلة أم غازية؟)
يمكن أن توجد اللافلزات في حالات المادة الثلاث: الصلبة والسائلة والغازية.
تعتمد حالة المادة اللافلزية على درجة الحرارة وظروف الضغط التي تتعرض لها.
من بين جميع اللافلزات في الجدول الدوري؛
- 11 من اللافلزات تكون في الحالة الغازية عند درجة حرارة الغرفة. [3]
- البروم (Br) هو مادة غير معدنية توجد في الحالة السائلة عند درجة حرارة الغرفة.
- أما بقية اللافلزات فهي مواد صلبة في درجة حرارة الغرفة.
اللافلزية الأكثر تفاعلاً
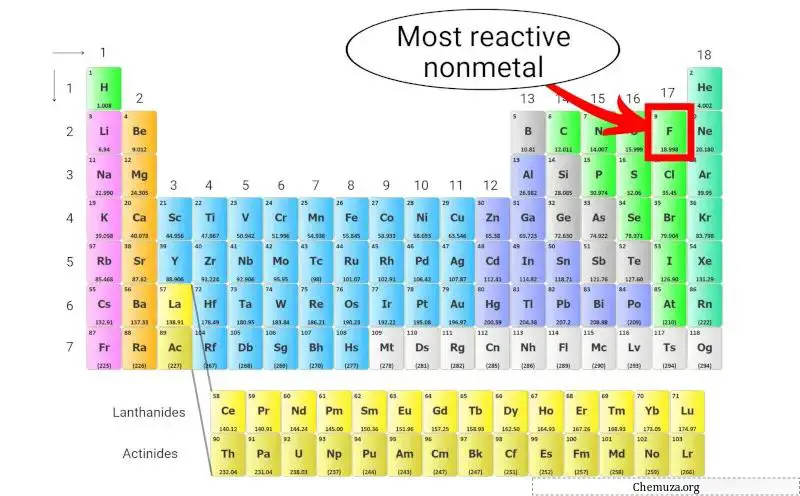
الفلور (F) هو أكثر العناصر غير المعدنية تفاعلية في الجدول الدوري.
لكن لماذا؟ لماذا يعتبر الفلورايد الأكثر تفاعلاً؟
وذلك لأنه يتمتع بأعلى سالبية كهربية بين جميع العناصر، مما يعني أنه يتمتع بجاذبية قوية للإلكترونات.
يحتوي الفلور على سبعة إلكترونات في مستوى الطاقة الخارجي له ويتطلب إلكترونًا إضافيًا لملء غلاف التكافؤ الخاص به والوصول إلى تكوين مستقر.
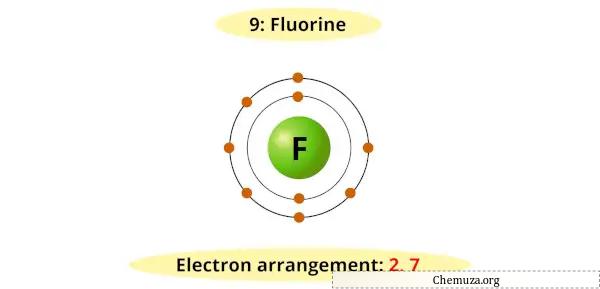
ولذلك، فهو يقبل بسهولة إلكترونًا من العناصر الأخرى لتكوين أيون الفلورايد (F-).
بسبب تفاعله العالي، يمكن أن يتفاعل الفلور بشكل انفجاري مع العديد من العناصر والمركبات الأخرى، بما في ذلك الماء والمعادن وحتى الزجاج. [4]
الفلور تفاعلي للغاية بحيث يتم تخزينه ونقله عادةً في حاويات متخصصة مصنوعة من مواد مقاومة لخصائصه المسببة للتآكل.
دور اللافلزات في التطبيقات البيئية والصناعية
تستخدم اللافلزات في مختلف العمليات الصناعية والتطبيقات البيئية بسبب خصائصها الفريدة. وهنا بعض الأمثلة:
- التحكم في تلوث الهواء: تلعب العناصر غير المعدنية مثل النيتروجين والأكسجين دورًا حيويًا في التحكم في تلوث الهواء. أكاسيد النيتروجين (NOx) هي ملوثات ضارة تنطلق من المركبات والعمليات الصناعية. تُستخدم المحفزات غير المعدنية لتحويل أكاسيد النيتروجين إلى غازات غير ضارة مثل النيتروجين والماء. وبالمثل، يُستخدم الأكسجين في عمليات الاحتراق لتقليل الانبعاثات الضارة.
- الأسمدة: يعتبر النيتروجين والفوسفور والكبريت من العناصر الغذائية الأساسية لنمو النبات. وتستخدم الأسمدة غير المعدنية مثل نترات الأمونيوم والسوبر فوسفات على نطاق واسع في الزراعة لزيادة إنتاجية المحاصيل.
- البطاريات: تستخدم في صناعة البطاريات العناصر غير المعدنية مثل الكبريت والكربون والليثيوم. تُستخدم بطاريات الليثيوم أيون بشكل شائع في الأجهزة الإلكترونية والمركبات الكهربائية وأنظمة الطاقة المتجددة.
- تنقية المياه: تُستخدم المواد غير المعدنية مثل الكلور واليود بشكل شائع كمطهرات في أنظمة تنقية المياه. فهي تقتل البكتيريا والفيروسات الضارة وتجعل المياه صالحة للشرب. [5]
- التصنيع الكيميائي: تستخدم المواد غير المعدنية مثل الكبريت والكلور على نطاق واسع في إنتاج المواد الكيميائية مثل حمض الكبريتيك وحمض الهيدروكلوريك والمذيبات القائمة على الكلور.
ملخص
تفتقر اللافلزات إلى خصائص المعادن مثل الموصلية الكهربائية العالية واللمعان وتقع على الجانب الأيمن من الجدول الدوري، باستثناء الهيدروجين. وهي موجودة في حالات المادة الثلاث اعتمادًا على درجة الحرارة وظروف الضغط.
الفلور هو أكثر اللافلزات تفاعلية بسبب سالبيته الكهربية العالية ويقبل بسهولة إلكترونًا من العناصر الأخرى لتكوين أيون الفلورايد (F-).
لللافلزات عدة استخدامات في التطبيقات البيئية والصناعية، بما في ذلك التحكم في تلوث الهواء والأسمدة والبطاريات وتنقية المياه والتصنيع الكيميائي.
