البروم (Br2) هو جزيء ثنائي الذرة يتكون من ذرتين من البروم. وهو سائل بني محمر في درجة حرارة الغرفة وشديد التفاعل. يتم استخدامه في مختلف الصناعات بما في ذلك الأدوية والزراعة ومعالجة المياه.
| اسم الأيوباك | البروم |
| الصيغة الجزيئية | ر2 |
| CAS رقم | 7726-95-6 |
| المرادفات | برومو، البروم الجزيئي، رقم الأمم المتحدة 1744، البروم ثنائي الذرة، البروم-79، البروم-81 |
| إنتشي | إنتشي = 1S/Br2/c1-2 |
خصائص البروم
صيغة البروم
الصيغة الكيميائية للبروم هي Br2. وهذا يعني أن جزيء البروم يحتوي على ذرتين من البروم. تُستخدم الصيغة لتمثيل تركيبة المادة وهي ضرورية في التفاعلات الكيميائية. تُستخدم تركيبة البروم في العديد من الصناعات، بما في ذلك الأدوية ومعالجة المياه والزراعة.
البروم الكتلة المولية
الكتلة المولية لـ Br2 هي 159.808 جم/مول. إنها كتلة مول واحد من جزيئات Br2. الكتلة المولية هي خاصية أساسية في الكيمياء لأنها تساعد في تحديد كمية المادة اللازمة لتفاعل معين. كما أنها تستخدم لتحويل الجرام والشامات من مادة ما.
نقطة غليان البروم
تبلغ درجة غليان Br2 58.8 درجة مئوية (137.8 درجة فهرنهايت). هذه هي درجة الحرارة التي يتحول عندها Br2 من سائل إلى غاز. ترجع نقطة الغليان المنخفضة لـ Br2 إلى ضعف قوى الجزيئات بين الجزيئات، مما يسمح للجزيئات بالهروب من الحالة السائلة بسهولة أكبر. التفاعل العالي لـ Br2 يجعله مادة خطيرة عند التعامل معها عند درجات حرارة عالية.
نقطة انصهار البروم
نقطة انصهار Br2 هي -7.2 درجة مئوية (19.0 درجة فهرنهايت). هذه هي درجة الحرارة التي يتحول عندها Br2 الصلب إلى الحالة السائلة. ترجع نقطة الانصهار المنخفضة لـ Br2 إلى القوى الجزيئية الضعيفة، والتي تسمح للجزيئات بالتحرك بسهولة أكبر في الحالة الصلبة. يتمتع Br2 بخاصية فريدة تتمثل في وجوده في صورة سائلة في درجة حرارة الغرفة، وهو أمر نادر بين الهالوجينات.
كثافة البروم جم/مل
تبلغ كثافة Br2 3.12 جم/مل. وهذا يعني أن المليلتر الواحد من Br2 له كتلة 3.12 جرام. تعود الكثافة العالية لـ Br2 إلى وزنه الجزيئي وضيق جزيئاته في الحالة السائلة. الكثافة العالية لـ Br2 تجعله مفيدًا في تفاعلات التخليق العضوي الثقيل.
الوزن الجزيئي للبروم
الوزن الجزيئي لـ Br2 هو 79.90 جم/مول. وهو مجموع الأوزان الذرية لذرتي Br في جزيء Br2. يعد الوزن الجزيئي خاصية أساسية في الكيمياء لأنه يساعد في تحديد كمية المادة اللازمة لتفاعل معين.
هيكل البروم
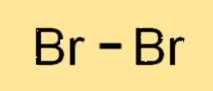
Br2 هو جزيء ثنائي الذرة، مما يعني أنه يتكون من ذرتين Br مرتبطتين ببعضهما البعض. تتشارك ذرتا Br2 في زوج من الإلكترونات لتشكل رابطة تساهمية. يمتلك جزيء Br2 بنية خطية، حيث يتم ترتيب ذرتي Br في خط مستقيم. يشبه هيكل Br2 الهالوجينات الأخرى مثل الكلور واليود.
| مظهر | سائل بني محمر |
| جاذبية معينة | 3.12 جم/مل |
| لون | بني محمر |
| يشم | رائحة نفاذة ومزعجة |
| الكتلة المولية | 159,808 جرام/مول |
| كثافة | 3.12 جم/مل |
| نقطة الانصهار | -7.2 درجة مئوية (19.0 درجة فهرنهايت) |
| نقطة الغليان | 58.8 درجة مئوية (137.8 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للاشتعال |
| الذوبان في الماء | 3.41 جم/100 مل (25 درجة مئوية) |
| الذوبان | قابل للذوبان في الكلوروفورم ورابع كلوريد الكربون والأثير |
| ضغط البخار | 1.13 كيلو باسكال عند 25 درجة مئوية |
| كثافة بخار | 5.4 جم/لتر |
| pKa | -5 |
| الرقم الهيدروجيني | غير قابل للتطبيق |
السلامة ومخاطر البروم
Br2 مادة كيميائية خطرة ويجب التعامل معها بحذر. وهو سائل أكال يمكن أن يسبب تهيجًا خطيرًا للجلد والعينين. استنشاق أبخرة Br2 يمكن أن يسبب مشاكل في الجهاز التنفسي والتعرض لمستويات عالية يمكن أن يكون قاتلاً. يعد Br2 أيضًا عامل مؤكسد قوي ويمكن أن يتفاعل بعنف مع المواد القابلة للاشتعال، مما يسبب حرائق أو انفجارات. يجب دائمًا ارتداء معدات الحماية المناسبة، مثل القفازات والنظارات الواقية وأجهزة التنفس، عند العمل مع Br2. يجب أن يتم تخزينه في مكان بارد وجاف وجيد التهوية، بعيدا عن مصادر الحرارة والمواد غير المتوافقة. في حالة حدوث انسكاب أو وقوع حادث، قم بإخلاء المنطقة على الفور واتبع إجراءات التنظيف المناسبة.
| رموز الخطر | الجمجمة والعظمتين المتقاطعتين، قابلة للتآكل |
| وصف الأمان | سامة للغاية ومسببة للتآكل ومهيجة للجلد والعينين والجهاز التنفسي. |
| أرقام تعريف الأمم المتحدة | UN1744 |
| رمز النظام المنسق | 2801.30 |
| فئة الخطر | 8 |
| مجموعة التعبئة | ثانيا |
| تسمم | الجرعة المميتة 50 (عن طريق الفم، الفئران) = 2 إلى 3 ملغم/كغم |
طرق تركيب البروم
يمكن استخدام طرق مختلفة لتركيب Br2، اعتمادًا على النقاء والكمية المطلوبة.
تتضمن إحدى الطرق معالجة المحلول الملحي بغاز الكلور في وجود عامل محفز مثل الحديد. يتم بعد ذلك تحميض المحلول الناتج من هيبوكلوريت الصوديوم وكلوريد الصوديوم بحمض الهيدروكلوريك، الذي يطلق غاز Br2.
تتضمن الطريقة الأخرى أكسدة غاز بروميد الهيدروجين بغاز الأكسجين في وجود محفز مثل البلاتين أو الأسبستوس. تستخدم الصناعات عادةً هذه الطريقة لإنتاج Br2 عالي النقاء لتطبيقاتها.
يستخرج التحليل الكهربائي Br2 من المحلول الملحي عن طريق تمرير تيار كهربائي عبر المحلول، الذي يفصل أيونات الصوديوم والكلوريد وينتج غاز Br2 كمنتج ثانوي.
استخدامات البروم
يمتلك Br2 عدة استخدامات هامة في مختلف الصناعات، بما في ذلك:
- يستخدم المصنعون المركبات القائمة على البروم كمثبطات للهب في المنسوجات والبلاستيك والمعدات الإلكترونية لتقليل مخاطر نشوب الحرائق عن طريق منع انتشار النيران.
- تقوم شركات الأدوية بدمج المركبات القائمة على البروم في إنتاج العديد من المهدئات والمهدئات والمسكنات.
- تستخدم محطات معالجة المياه المركبات القائمة على البروم كمطهر لقتل البكتيريا والفيروسات والكائنات الضارة الأخرى بشكل فعال.
- يستخدم منتجو المبيدات الحشرية ومبيدات الأعشاب المركبات القائمة على البروم للسيطرة بشكل فعال على الآفات والأعشاب الضارة.
- تستخدم صناعة النفط والغاز مركبات أساسها البروم في عمليات الحفر للتحكم في التآكل وتحسين استخلاص النفط.
- يستخدم المنتجون المركبات القائمة على البروم في إنتاج الأفلام والأوراق الفوتوغرافية للتحكم بشكل فعال في حساسية الصور وتباينها.
- تستخدم تفاعلات التخليق الكيميائي Br2 كمادة متفاعلة لإنتاج الأصباغ والمواد البلاستيكية والمستحضرات الصيدلانية.
أسئلة:
س: هل Br2 قطبي أم غير قطبي؟
ج: Br2 هو جزيء غير قطبي لأن ذرتي البروم لهما نفس السالبية الكهربية، مما يؤدي إلى مشاركة متساوية للإلكترونات في الرابطة التساهمية.
س: ما المركب الذي يحتوي على الأرجح على روابط تساهمية قطبية؟ كلوريد الصوديوم، AlF3، Br2، NF3؟
ج: المركب الذي يحتوي على روابط تساهمية قطبية على الأرجح هو NF3 (ثلاثي فلوريد النيتروجين)، لأن ذرات النيتروجين والفلور لها سالبية كهربية مختلفة جدًا، مما يؤدي إلى مشاركة غير متساوية للإلكترونات في الرابطة التساهمية.
س: ما قيمة ΔH0 لهذا التفاعل؟ Br2 (ز) → Br2 (ل)، ΔHf° Br2 (ز) = 30.91 كيلوجول/مول
ج: إن ΔH0 للتفاعل هو -10.57 كيلوجول/مول، لأن حرارة تبخر Br2 هي 41.48 كيلوجول/مول وحرارة الانصهار هي 30.91 كيلوجول/مول (مذكورة في السؤال).
س: هل Br2 غاز؟
ج: يمكن أن يتواجد Br2 في الحالة الغازية والسائلة حسب درجة الحرارة وظروف الضغط. عند درجة حرارة الغرفة والضغط القياسي، يكون Br2 سائلًا بني محمر.
س: ما هو استخدام البروم؟
ج: للبروم عدة استخدامات مهمة في مختلف الصناعات، بما في ذلك مثبطات اللهب، ومعالجة المياه، والأدوية، والمبيدات الحشرية، وصناعة النفط والغاز، والتصوير الفوتوغرافي، والتخليق الكيميائي.
س: هل البروم معدن؟
ج: لا، البروم ليس معدنًا. وهو عنصر غير معدني في مجموعة الهالوجين في الجدول الدوري.
