ما هي الأمونيا؟
الأمونيا أو NH3 عبارة عن غاز لاذع عديم اللون يتكون من النيتروجين والهيدروجين، ويستخدم على نطاق واسع في الصناعة كمبرد وعامل تنظيف وأسمدة.
| اسم الأيوباك | الأمونيا |
| الصيغة الجزيئية | NH3 |
| CAS رقم | 7664-41-7 |
| المرادفات | أزان، ثلاثي هيدريد النيتروجين، كحول هارتشورن |
| إنتشي | إنتشي = 1S/NH3/c1-2 |
خصائص الأمونيا
هيكل لويس للأمونيا
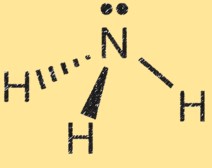
يوضح هيكل لويس للأمونيا (NH3) ترتيب الإلكترونات في الجزيء. في بنية لويس، تمثل النقاط الإلكترونات والخطوط تمثل الروابط بين الذرات.
يُظهر هيكل لويس للأمونيا ذرة النيتروجين محاطة بثلاث ذرات هيدروجين وزوج من الإلكترونات المشتركة بين ذرات النيتروجين والهيدروجين. وهذا يمثل الروابط التساهمية في الجزيء. تحتوي ذرة النيتروجين على خمسة إلكترونات تكافؤ، ولكل ذرة هيدروجين إلكترون تكافؤ واحد. في بنية لويس للأمونيا، تشكل ذرة النيتروجين ثلاث روابط فردية مع ذرات الهيدروجين ولها زوج واحد غير مشترك من الإلكترونات.
صيغة الأمونيا
الصيغة الكيميائية للأمونيا هي NH3. تشير الصيغة إلى وجود ثلاث ذرات هيدروجين وذرة نيتروجين واحدة في كل جزيء أمونيا. تمثل الصيغة تركيبة المادة وتوفر معلومات مهمة حول خصائصها وسلوكها.
NH3 الكتلة المولية
الكتلة المولية للمادة هي كتلة مول واحد من المادة ويتم التعبير عنها بالجرام لكل مول. الكتلة المولية للأمونيا (NH3) هي 17.0307 جم/مول. وهذا يعني أن كتلة المول الواحد من الأمونيا تساوي 17.0307 جرامًا. تعتبر الكتلة المولية للمادة مهمة في تحديد عدد الشامات في عينة معينة ويمكن استخدامها لتحديد كتلة الصيغة للمركب.
درجة غليان الأمونيا
NH3 لديه نقطة غليان -33.34 درجة مئوية (-28.012 درجة فهرنهايت). نقطة غليان المادة هي درجة الحرارة التي يتساوى عندها ضغط بخار المادة مع الضغط الجوي وتبدأ في التحول من الحالة السائلة إلى الحالة الغازية. درجة غليان NH3 منخفضة نسبيًا مقارنة بالمواد الكيميائية الأخرى، مما يجعله مبردًا مفيدًا في أنظمة التبريد والتبريد.
نقطة الانصهار NH3
NH3 لديه نقطة انصهار تبلغ -77.73 درجة مئوية (-107.87 درجة فهرنهايت). نقطة انصهار المادة هي درجة الحرارة التي تتحول عندها من الحالة الصلبة إلى الحالة السائلة. نقطة الانصهار المنخفضة لـ NH3 تجعله مبردًا مفيدًا، حيث يمكن تكثيفه بسهولة من غاز إلى سائل، مما يسمح له بامتصاص الحرارة أثناء تغير حالته.
كثافة NH3 جم/مل
كثافة المادة هي كتلة العينة لكل وحدة حجم. تبلغ كثافة NH3 0.769 جم / مل. وهذا يعني أن الملليلتر الواحد من NH3 له كتلة 0.769 جرام. يمكن استخدام كثافة المادة لتحديد كمية المادة الموجودة في حجم معين، وهي خاصية مهمة لفهم كيفية تصرف المادة في الحالات المختلفة.
NH3 الوزن الجزيئي
الوزن الجزيئي للمادة هو مجموع الأوزان الذرية لجميع الذرات الموجودة في جزيء واحد من المادة. الوزن الجزيئي لـ NH3 (NH3) هو 17.0307 جم/مول. وهذا يعني أن الوزن الجزيئي لجزيء NH3 يبلغ 17.0307 جرامًا لكل مول. الوزن الجزيئي للمادة مهم في تحديد عدد الشامات في عينة معينة ويمكن استخدامه لتحديد كتلة الصيغة للمركب.
هيكل NH3
NH3 هو جزيء يتكون من ثلاث ذرات هيدروجين وذرة نيتروجين واحدة. ترتبط ذرة النيتروجين بذرات الهيدروجين عبر رابطة تساهمية ويكون للجزيء شكل هرمي ثلاثي. تبلغ زوايا الرابطة في الجزيء حوالي 107 درجة. NH3 هو جزيء قطبي، مما يعني أن له نهاية إيجابية وسلبية، ويستخدم عادة كمذيب وكاشف في التفاعلات الكيميائية.
| مظهر | غاز عديم اللون |
| جاذبية معينة | 0.59 (الهواء = 1) |
| لون | عديم اللون |
| يشم | رائحة نفاذة وقوية |
| الكتلة المولية | 17.0307 جم/مول |
| كثافة | 0.769 جم/مل |
| نقطة الانصهار | -77.73 درجة مئوية |
| نقطة الغليان | -33.34 درجة مئوية |
| نقطة فلاش | لا ينطبق (الغاز) |
| الذوبان في الماء | قابل للذوبان للغاية |
| الذوبان | قابل للذوبان في الماء ومعظم المذيبات العضوية |
| ضغط البخار | 50.7 كيلو باسكال عند 20 درجة مئوية |
| كثافة بخار | 0.59 (الهواء = 1) |
| pKa | 4.75 |
| الرقم الهيدروجيني | 11.6 (محلول مشبع) |
سلامة الأمونيا ومخاطرها
NH3 هو غاز شديد السمية ومسبب للتآكل ويمكن أن يضر بشكل خطير بصحة الإنسان والبيئة إذا لم يتم التعامل معه بشكل صحيح. يمكن أن يسبب NH3 حروقًا شديدة في العينين والجلد والجهاز التنفسي، ويمكن أن يكون مميتًا أيضًا إذا تم استنشاقه بتركيزات عالية. بالإضافة إلى ذلك، NH3 شديد التفاعل ويمكن أن يشتعل أو ينفجر إذا لامس مواد كيميائية أو مواد معينة.
من المهم اتخاذ احتياطات السلامة عند التعامل مع NH3 أو العمل معه. ويشمل ذلك ارتداء الملابس الواقية، مثل القفازات والنظارات الواقية وقناع الوجه، بالإضافة إلى توفير التهوية الكافية لتجنب استنشاق الغاز. ومن المهم أيضًا تخزين NH3 في مناطق جيدة التهوية، بعيدًا عن مصادر الحرارة والمواد الأخرى القابلة للاشتعال. إذا تعرضت لـ NH3، فمن المهم إزالة الملابس الملوثة وشطف المنطقة المصابة بالكثير من الماء. اطلب العناية الطبية فورًا في حالة ظهور أعراض التعرض.
| رموز الخطر | تي+، ن |
| وصف الأمان | خطير على البيئة، ضار عن طريق الاستنشاق، مهيج |
| معرفات | الأمم المتحدة 1005 |
| رمز النظام المنسق | 2814.1 |
| فئة الخطر | 2.3 |
| مجموعة التعبئة | ثانيا |
| تسمم | جرعة شديدة السمية ومميتة (الاستنشاق) – 33-66 جزء في المليون |
طرق تركيب الأمونيا
هناك عدة طرق لتصنيع الأمونيا، بما في ذلك عملية هابر، وعملية أوستفالد، وعملية بيركيلاند-إيد.
تعد عملية هابر، والمعروفة أيضًا باسم عملية هابر-بوش، الطريقة الأكثر استخدامًا على نطاق واسع لتخليق الأمونيا صناعيًا. في هذه العملية، يتفاعل غاز النيتروجين الموجود في الهواء مع غاز الهيدروجين عبر محفز الحديد لتكوين الأمونيا. ويحدث التفاعل تحت ضغط مرتفع (حوالي 150 ضغط جوي) وعند درجة حرارة تتراوح بين 450-500 درجة مئوية. تعتبر عملية هابر فعالة للغاية، حيث تنتج كميات كبيرة من الأمونيا بإنتاجية عالية، وتستخدم كمصدر رئيسي للأمونيا لإنتاج الأسمدة والمواد الكيميائية الأخرى.
عملية أوستفالد، والمعروفة أيضًا بعملية تثبيت النيتروجين، هي طريقة قديمة لتخليق الأمونيا تتضمن أكسدة غاز النيتروجين إلى أكسيد النيتريك، يليه تفاعل أكسيد النيتريك مع المزيد من غاز النيتروجين لتكوين الأمونيا. هذه العملية أقل كفاءة وتم استبدالها إلى حد كبير بعملية هابر.
عملية بيركلاند-إيد، والمعروفة أيضًا باسم عملية البلازما، هي طريقة أحدث لتخليق الأمونيا تستخدم تفريغ البلازما لفصل غازات النيتروجين والهيدروجين وتكوين الأمونيا. ولا تزال هذه العملية في مرحلة التطوير ولم يتم اعتمادها على نطاق واسع للاستخدام الصناعي.
باختصار، تعد عملية هابر هي الطريقة الأكثر استخدامًا لتخليق الأمونيا، في حين أن عملية أوستوالد وعملية بيركيلاند-إيد هما طريقتان أقدم أو أقل استخدامًا.
استخدامات الأمونيا
الأمونيا مادة كيميائية متعددة الاستخدامات ولها نطاق واسع من الاستخدامات في الصناعة والزراعة. بعض الاستخدامات الرئيسية للأمونيا تشمل:
- إنتاج الأسمدة: المكون الرئيسي في إنتاج الأسمدة النيتروجينية، الأمونيا يزيد من إنتاجية المحاصيل ويحسن خصوبة التربة.
- التبريد: تستخدم أنظمة التبريد الصناعية والمنزلية الأمونيا كمبرد، بما في ذلك الثلاجات والمجمدات.
- التنظيف: غالبًا ما تحتوي منتجات التنظيف المنزلية على الأمونيا بسبب قدرتها على إذابة الشحوم والأوساخ.
- المستحضرات الصيدلانية: يتم في إنتاج المنتجات الصيدلانية المختلفة، مثل مضادات الحموضة وشراب السعال، استخدام الأمونيا كمادة خام.
- إنتاج المنسوجات: يتم استخدام الأمونيا في صباغة المنسوجات وطباعتها، وكذلك إنتاج الألياف الاصطناعية.
- معالجة النفايات: معالجة مياه الصرف الصحي والسيطرة على الرائحة من محطات معالجة مياه الصرف الصحي تنطوي على استخدام الأمونيا.
- مثبطات اللهب: تعمل الأمونيا كمثبطات للهب في إنتاج المواد مثل البلاستيك والمطاط وغيرها.
- إنتاج النفط والغاز: تستخدم صناعة النفط والغاز الأمونيا لإنتاج مواد كيميائية مختلفة، بما في ذلك المواد الخافضة للتوتر السطحي ومزيلات الاستحلاب.
في الختام، الأمونيا مادة كيميائية متعددة الاستخدامات ولها نطاق واسع من الاستخدامات في مختلف الصناعات والتطبيقات، بما في ذلك الزراعة والتبريد والتنظيف والأدوية وإنتاج المنسوجات ومعالجة النفايات ومثبطات اللهب وإنتاج النفط والغاز.
أسئلة:
هل الأمونيا حمض أم قاعدة؟
تعتبر الأمونيا قاعدة. في المحاليل المائية، يذوب لتكوين أيونات الهيدروكسيد (OH-) ويعمل كقاعدة ضعيفة. تحتوي الأمونيا على درجة حموضة أساسية (قلوية)، عادة حوالي 11. يمكن لمحاليل الأمونيا معادلة الأحماض لتكوين الملح والماء، وهي إحدى الخصائص المميزة للقاعدة. في التفاعلات الكيميائية، يمكن للأمونيا أيضًا أن تعمل ككائن محب للنواة وتشارك في التفاعلات التي تشكل الأميدات، وهي مشتقات من الأمونيا وتحتوي على رابطة النيتروجين والكربون المميزة للأمينات والأميدات.
هل الأمونيا قطبية؟
نعم الأمونيا قطبية. وله هندسة جزيئية منحنية مع ذرة نيتروجين مركزية محاطة بثلاث ذرات هيدروجين. يخلق هذا الشكل عزمًا ثنائي القطب دائمًا، حيث يقع الطرف الموجب لثنائي القطب عند ذرات الهيدروجين والطرف السالب عند ذرة النيتروجين. الطبيعة القطبية للأمونيا تسمح لها بالذوبان في المذيبات القطبية مثل الماء، وهي خاصية من سمات الجزيئات القطبية. تسمح الطبيعة القطبية للأمونيا أيضًا بالمشاركة في الروابط الهيدروجينية، وهو نوع من القوة الجزيئية التي تحدث بين الجزيئات القطبية. يمكن أن يؤدي هذا الارتباط الهيدروجيني إلى نقاط غليان وانصهار أعلى من الجزيئات غير القطبية ذات الحجم المماثل.
