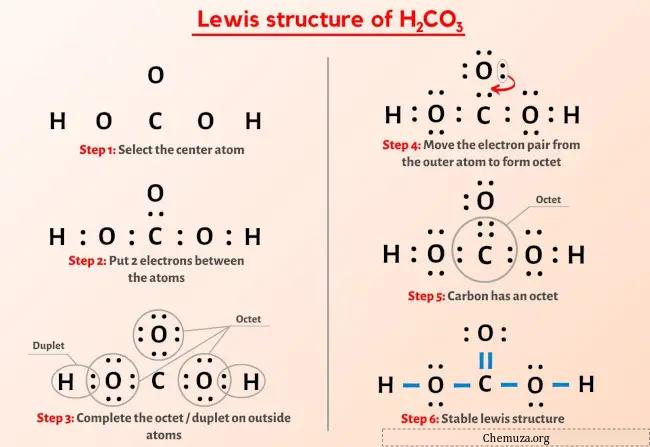
لقد رأيت الصورة أعلاه بالفعل، أليس كذلك؟
اسمحوا لي أن أشرح بإيجاز الصورة أعلاه.
يحتوي هيكل H2CO3 Lewis على ذرة كربون (C) في المركز محاطة بذرة أكسجين (O) ومجموعتين OH. توجد رابطة مزدوجة واحدة بين ذرة الكربون (C) وذرة الأكسجين (O) وبقية الذرات الأخرى لها رابطة واحدة. هناك زوجان وحيدان من ذرات الأكسجين الثلاث (O).
إذا لم تفهم أي شيء من الصورة أعلاه لبنية لويس لـ H2CO3، فابق معي وستحصل على شرح مفصل خطوة بخطوة حول كيفية رسم بنية لويس لـ H2CO3 .
لذلك دعونا ننتقل إلى خطوات رسم بنية لويس لجزيء H2CO3.
خطوات رسم هيكل لويس H2CO3
الخطوة 1: أوجد العدد الإجمالي لإلكترونات التكافؤ في جزيء H2CO3
من أجل العثور على العدد الإجمالي لإلكترونات التكافؤ في جزيء H_2CO3، عليك أولا معرفة إلكترونات التكافؤ الموجودة في ذرة الهيدروجين ، ذرة الكربون وكذلك ذرة الأكسجين.
(إلكترونات التكافؤ هي الإلكترونات الموجودة في المدار الخارجي لأي ذرة).
سأخبرك هنا بكيفية العثور بسهولة على إلكترونات التكافؤ للهيدروجين والكربون وكذلك الأكسجين باستخدام الجدول الدوري.
إجمالي إلكترونات التكافؤ في جزيء H2CO3
→ إلكترونات التكافؤ المعطاة من ذرة الهيدروجين:
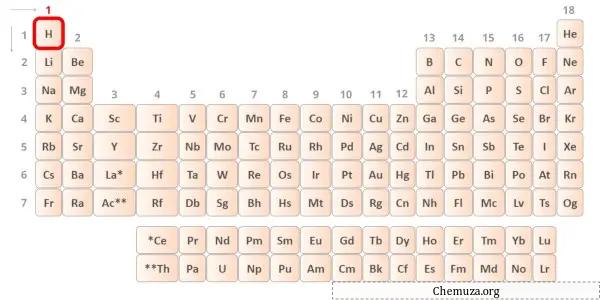
الهيدروجين هو عنصر المجموعة 1 في الجدول الدوري. [1] ولذلك فإن إلكترون التكافؤ الموجود في الهيدروجين هو 1 .

يمكنك أن ترى أن إلكترون تكافؤ واحد فقط موجود في ذرة الهيدروجين كما هو موضح في الصورة أعلاه.
→ إلكترونات التكافؤ المعطاة من ذرة الكربون:
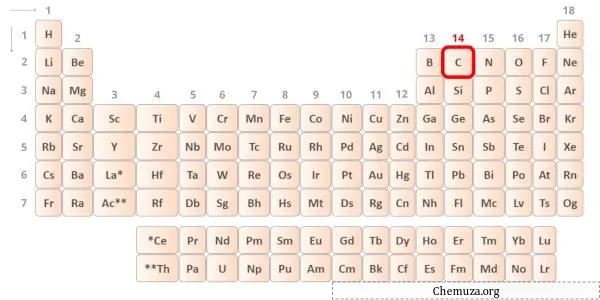
الكربون هو أحد عناصر المجموعة 14 من الجدول الدوري. [2] ولذلك فإن إلكترونات التكافؤ الموجودة في الكربون هي 4 .
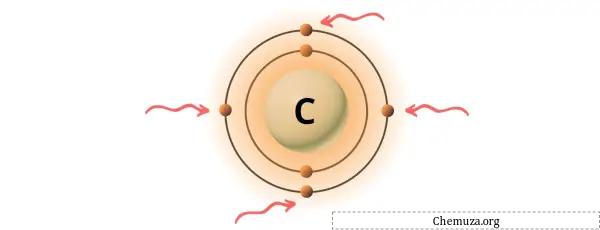
يمكنك رؤية إلكترونات التكافؤ الأربعة الموجودة في ذرة الكربون كما هو موضح في الصورة أعلاه.
→ إلكترونات التكافؤ المعطاة من ذرة الأكسجين:

الأكسجين هو عنصر في المجموعة 16 من الجدول الدوري. [3] ولذلك فإن إلكترونات التكافؤ الموجودة في الأكسجين هي 6 .
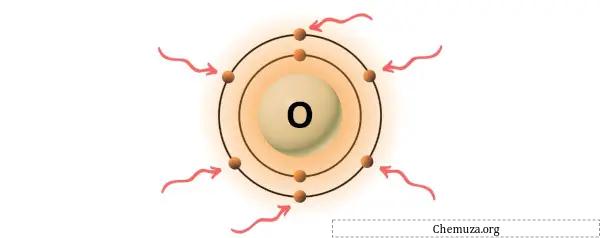
يمكنك رؤية إلكترونات التكافؤ الستة الموجودة في ذرة الأكسجين كما هو موضح في الصورة أعلاه.
لذا،
إجمالي إلكترونات التكافؤ في جزيء H2CO3 = إلكترونات التكافؤ المقدمة من ذرتين هيدروجين + إلكترونات التكافؤ المقدمة من ذرة كربون واحدة + إلكترونات التكافؤ المقدمة من 3 ذرات أكسجين = 1(2) + 4 + 6 (3) = 24.
الخطوة 2: حدد الذرة المركزية
لاختيار الذرة المركزية، يجب أن نتذكر أن الذرة الأقل سالبية كهربية تبقى في المركز.
(تذكر: إذا كان الهيدروجين موجودًا في الجزيء المحدد، ضع الهيدروجين دائمًا في الخارج).
الآن هنا الجزيء المحدد هو H2CO3 ويحتوي على ذرة الهيدروجين (H)، وذرة الكربون (C) وذرات الأكسجين (O).
لذا، وفقًا للقاعدة، علينا إبقاء الهيدروجين خارجًا.
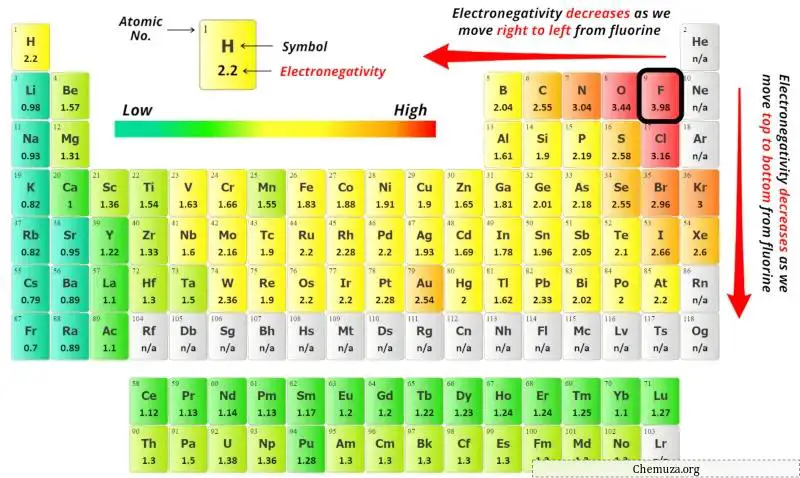
يمكنك الآن رؤية قيم السالبية الكهربية لذرة الكربون (C) وذرة الأكسجين (O) في الجدول الدوري أعلاه.
إذا قارنا قيم السالبية الكهربية للكربون (C) والأكسجين (O)، فإن ذرة الكربون أقل سالبية كهربية .
هنا، ذرة الكربون (C) هي الذرة المركزية وذرات الأكسجين (O) هي الذرة الخارجية.
الخطوة 3: قم بتوصيل كل ذرة عن طريق وضع زوج من الإلكترونات بينهما
الآن، في جزيء H2CO3، تحتاج إلى وضع أزواج الإلكترونات بين ذرات الأكسجين (O) والهيدروجين (H) وبين ذرات الأكسجين (O) والكربون (C).

يشير هذا إلى أن هذه الذرات مرتبطة كيميائيًا ببعضها البعض في جزيء H2CO3.
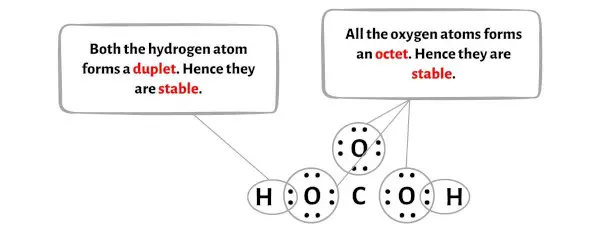
الخطوة 4: جعل الذرات الخارجية مستقرة
في هذه الخطوة تحتاج إلى التحقق من استقرار الذرات الخارجية.
هنا في رسم جزيء H2CO3 يمكنك أن ترى أن الذرات الخارجية هي ذرات الهيدروجين والأكسجين.
تشكل ذرات الهيدروجين والأكسجين ثنائيًا وثمانيًا على التوالي، وبالتالي فهي مستقرة.
بالإضافة إلى ذلك، في الخطوة 1، قمنا بحساب العدد الإجمالي لإلكترونات التكافؤ الموجودة في جزيء H2CO3.
يحتوي جزيء H2CO3 على إجمالي 24 إلكترونًا تكافؤًا ، ويتم استخدام جميع إلكترونات التكافؤ هذه في الرسم البياني أعلاه.
وبالتالي، لا يوجد المزيد من أزواج الإلكترونات التي يمكن الاحتفاظ بها في ذرة الكربون المركزية.
والآن دعونا ننتقل إلى الخطوة التالية.
الخطوة 5: التحقق من الثماني على الذرة المركزية. إذا لم يكن لديه ثماني بتات، قم بتحريك الزوج الوحيد لتكوين رابطة مزدوجة أو رابطة ثلاثية.
في هذه الخطوة، عليك التحقق مما إذا كانت ذرة الكربون المركزية (C) مستقرة أم لا.
من أجل التحقق من استقرار ذرة الكربون المركزية (C)، نحتاج إلى التحقق مما إذا كانت تشكل ثمانيًا أم لا.
ولسوء الحظ، فإن ذرة الكربون لا تشكل ثمانيًا هنا. يحتوي الكربون على 6 إلكترونات فقط وهو غير مستقر.
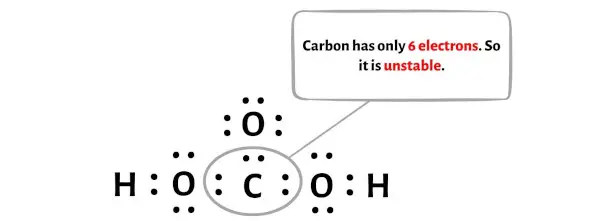
الآن، لجعل ذرة الكربون هذه مستقرة، تحتاج إلى إزاحة زوج الإلكترونات لذرة الأكسجين الخارجية بحيث يمكن أن تحتوي ذرة الكربون على 8 إلكترونات (أي ثماني واحد).
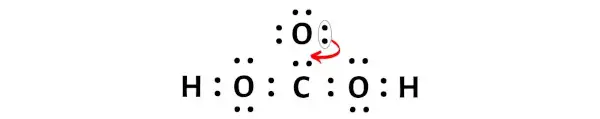
بعد تحريك هذا الزوج من الإلكترونات، ستستقبل ذرة الكربون المركزية إلكترونين إضافيين، وبالتالي يصبح إجمالي إلكتروناتها 8.
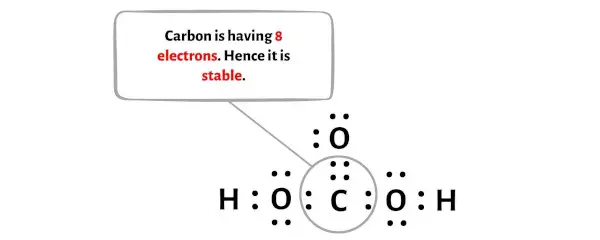
يمكنك أن ترى في الصورة أعلاه أن ذرة الكربون تشكل ثمانيًا لأنها تحتوي على 8 إلكترونات.
الآن دعنا ننتقل إلى الخطوة الأخيرة للتحقق مما إذا كانت بنية لويس المذكورة أعلاه مستقرة أم لا.
الخطوة 6: التحقق من استقرار هيكل لويس
لقد وصلت الآن إلى الخطوة الأخيرة التي تحتاج فيها إلى التحقق من ثبات بنية لويس لـ H2CO3.
يمكن التحقق من استقرار بنية لويس باستخدام مفهوم الشحن الرسمي .
باختصار، يجب علينا الآن إيجاد الشحنة الرسمية لذرات الهيدروجين (H)، والكربون (C)، والأكسجين (O) الموجودة في جزيء H2CO3.
لحساب الضريبة الرسمية، يجب عليك استخدام الصيغة التالية:
الشحنة الرسمية = إلكترونات التكافؤ – (الإلكترونات الرابطة)/2 – الإلكترونات غير الرابطة
يمكنك رؤية عدد الإلكترونات الرابطة والإلكترونات غير الرابطة لكل ذرة من جزيء H2CO3 في الصورة أدناه.
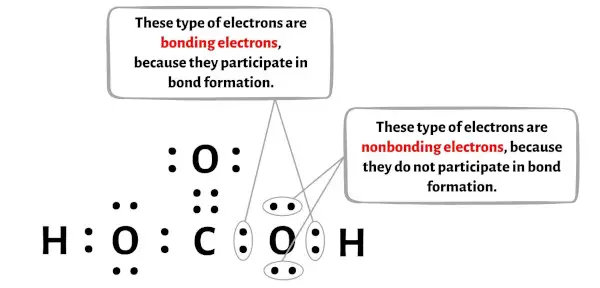
لذرة الهيدروجين (H):
إلكترون التكافؤ = 1 (لأن الهيدروجين موجود في المجموعة 1)
إلكترونات الرابطة = 2
الإلكترونات غير الرابطة = 0
بالنسبة لذرة الكربون (C):
إلكترونات التكافؤ = 4 (لأن الكربون موجود في المجموعة 14)
إلكترونات الرابطة = 8
الإلكترونات غير الرابطة = 0
بالنسبة لذرة الأكسجين ثنائية الرابطة (O):
إلكترونات التكافؤ = 6 (لأن الأكسجين موجود في المجموعة 16)
إلكترونات الرابطة = 4
الإلكترونات غير الرابطة = 4
بالنسبة لذرة الأكسجين أحادية الرابطة (O):
إلكترونات التكافؤ = 6 (لأن الأكسجين موجود في المجموعة 16)
إلكترونات الرابطة = 4
الإلكترونات غير الرابطة = 4
| اتهام رسمي | = | إلكترونات التكافؤ | – | (الإلكترونات الملزمة)/2 | – | الإلكترونات غير الرابطة | ||
| ح | = | 1 | – | 2/2 | – | 0 | = | 0 |
| ضد | = | 4 | – | 8/2 | – | 0 | = | 0 |
| يا (قفزة مزدوجة) | = | 6 | – | 4/2 | – | 4 | = | 0 |
| يا (رابطة واحدة) | = | 6 | – | 4/2 | – | 4 | = | 0 |
من حسابات الشحنة الرسمية أعلاه، يمكنك أن ترى أن ذرات الهيدروجين (H)، والكربون (C)، وكذلك الأكسجين (O) لها شحنة رسمية “صفر” .
يشير هذا إلى أن بنية لويس أعلاه لـ H2CO3 مستقرة ولا يوجد أي تغيير إضافي في البنية أعلاه لـ H2CO3.
في بنية لويس النقطية أعلاه لـ H2CO3، يمكنك أيضًا تمثيل كل زوج من إلكترونات الترابط (:) كرابطة واحدة (|). سيعطيك القيام بذلك بنية لويس التالية لـ H2CO3.
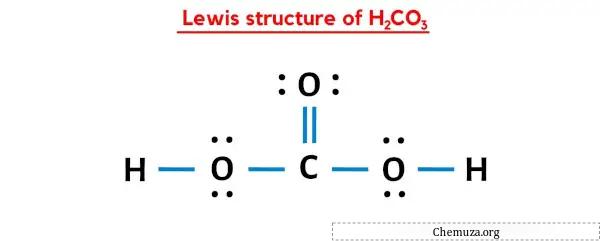
أتمنى أن تكون قد فهمت جميع الخطوات المذكورة أعلاه تمامًا.
لمزيد من التدريب والفهم الأفضل، يمكنك تجربة هياكل لويس الأخرى المدرجة أدناه.
جرب (أو على الأقل شاهد) هياكل لويس هذه لفهم أفضل:
