هيدروكسيد الكالسيوم (Ca(OH)2) هو مركب كيميائي يستخدم في تطبيقات مختلفة مثل إنتاج الغذاء، ومعالجة المياه، والبناء. يتم تصنيعه عن طريق خلط أكسيد الكالسيوم مع الماء وله مظهر مسحوقي أبيض.
| اسم الأيوباك | هيدروكسيد الكالسيوم |
| الصيغة الجزيئية | الكالسيوم (أوه) 2 |
| CAS رقم | 1305-62-0 |
| المرادفات | ليمون مطفأ، ليمون مطفأ، لبن ليمون، ليمون مخلل |
| إنتشي | InChI=1S/Ca.2H2O/h;2*1H2/q+2;;/p-2 |
خصائص هيدروكسيد الكالسيوم
صيغة هيدروكسيد الكالسيوم
الصيغة الكيميائية لهيدروكسيد الكالسيوم هي Ca(OH)2. وهذا يعني أن كل جزيء من هيدروكسيد الكالسيوم يحتوي على أيون Ca2+ واحد وأيونات OH-. الصيغة مهمة في الكيمياء لأنها تمثل عدد وأنواع الذرات الموجودة في المركب.
هيدروكسيد الكالسيوم الكتلة المولية
Ca(OH)2 له كتلة مولية قدرها 74.09 جم/مول. وتتكون من ذرة كالسيوم واحدة وذرتين أكسجين وذرتين هيدروجين. الكتلة المولية هي خاصية مهمة في الكيمياء لأنها تستخدم لحساب كمية المادة في عينة معينة.
نقطة غليان هيدروكسيد الكالسيوم
درجة غليان Ca(OH)2 عالية جدًا تبلغ 2400 درجة مئوية. وهذا يعني أن الأمر يتطلب كمية كبيرة من الحرارة لتحويله من سائل إلى غاز. ترجع نقطة الغليان العالية إلى الروابط الأيونية القوية بين أيونات الكالسيوم والهيدروكسيد.
نقطة انصهار هيدروكسيد الكالسيوم
يتميز Ca(OH)2 بنقطة انصهار منخفضة نسبيًا تبلغ 580 درجة مئوية. وهذا يعني أنه يمكن صهره بسهولة وتشكيله في أشكال مختلفة. ترجع نقطة الانصهار المنخفضة إلى الطبيعة الأيونية للمركب، والتي تسمح للأيونات بالتحرك بحرية أكبر عند تسخينها.
كثافة هيدروكسيد الكالسيوم جم/مل
تبلغ كثافة Ca(OH)2 2.24 جم/مل. وهذا يعني أنه مركب ثقيل نسبيًا، مقارنة بالماء الذي تبلغ كثافته 1 جم / مل. ترجع الكثافة العالية إلى الطبيعة المدمجة جدًا لأيونات Ca2+ وOH-.
الوزن الجزيئي لهيدروكسيد الكالسيوم
الوزن الجزيئي لـ Ca(OH)2 هو 74.09 جم/مول. هذا هو مجموع الأوزان الذرية لذرات الكالسيوم والأكسجين والهيدروجين الموجودة في المركب. الوزن الجزيئي هو خاصية مهمة في الكيمياء، حيث يتم استخدامه لحساب عوامل مختلفة مثل المولارية ونسبة التركيب.
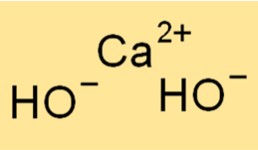
هيكل هيدروكسيد الكالسيوم
يحتوي Ca(OH)2 على بنية بلورية، حيث يحيط بكل أيون كالسيوم بستة أيونات هيدروكسيد في ترتيب ثماني السطوح. يمنح هذا الهيكل المركب مظهره الأبيض والبودري المميز. الروابط الأيونية بين أيونات Ca2+ وOH- قوية، مما يمنح المركب نقاط انصهار وغليان عالية.
| مظهر | بودرة بيضاء |
| جاذبية معينة | 2.24 جم/سم3 |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 74.09 جرام/مول |
| كثافة | 2.24 جم/سم3 |
| نقطة الانصهار | 580 درجة مئوية |
| نقطة الغليان | 2400 درجة مئوية |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | 1.7 جم/لتر (20 درجة مئوية) |
| الذوبان | قابل للذوبان في الأحماض |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | 12.5 (التفكك الأول) |
| الرقم الهيدروجيني | 12.5 (محلول 0.1 م، 25 درجة مئوية) |
سلامة ومخاطر هيدروكسيد الكالسيوم
يعتبر Ca(OH)2 آمنًا بشكل عام عند التعامل معه بشكل صحيح. ومع ذلك، يمكن أن يكون ضارًا إذا تم تناوله أو استنشاقه أو إذا ملامسة الجلد أو العينين. هذا يمكن أن يسبب تهيج وحروق ومشاكل في التنفس. يمكن أن يؤدي الغبار الناتج عن المركب أيضًا إلى تهيج الجهاز التنفسي. يجب ارتداء معدات الحماية مثل القفازات والنظارات الواقية وأجهزة التنفس عند التعامل مع Ca(OH)2. يجب أيضًا تخزين المركب في منطقة باردة وجافة وجيدة التهوية بعيدًا عن المواد غير المتوافقة. في حالة ملامسته أو ابتلاعه، اطلب العناية الطبية على الفور.
| رموز الخطر | شي (مزعج) |
| وصف الأمان | ارتداء القفازات الواقية وحماية العين/الوجه. |
| أرقام تعريف الأمم المتحدة | أ 1910 |
| رمز النظام المنسق | 2825.90.90 |
| فئة الخطر | 8- المواد المسببة للتآكل |
| مجموعة التعبئة | ثالثا |
| تسمم | يعتبر هيدروكسيد الكالسيوم بشكل عام غير سام عند التعامل معه بشكل صحيح. ومع ذلك، يمكن أن يؤدي الابتلاع أو الاستنشاق إلى تهيج وحرق الجهاز التنفسي والجهاز الهضمي. |
طرق تصنيع هيدروكسيد الكالسيوم
يمكن لطرق مختلفة تصنيع Ca(OH)2.
الطريقة الشائعة لتصنيع Ca(OH)2 هي تفاعل الماء مع أكسيد الكالسيوم ، مما يؤدي إلى تكوين الجير المطفأ أو الجير المطفأ.
تتضمن الطريقة الأخرى تفاعل كلوريد الكالسيوم مع هيدروكسيد الصوديوم. تفاعل الماء وثاني أكسيد الكربون مع كربونات الكالسيوم ينتج Ca(OH)2.
تتضمن عملية الترطيب خلط الماء مع أكسيد الكالسيوم باستخدام طريقة الجير المطفأ. ينتج عن هذا التفاعل Ca(OH)2 والحرارة كمنتج ثانوي. تعمل هذه العملية أيضًا على إزالة الشوائب والماء الزائد من المعجون الناتج.
تتضمن طريقة كلوريد الكالسيوم خلط كلوريد الكالسيوم وهيدروكسيد الصوديوم في عملية تسمى التحلل المزدوج.
ينتج عن هذا التفاعل Ca(OH)2 وكلوريد الصوديوم كمنتجات ثانوية. تتم بعد ذلك تنقية Ca(OH)2 الناتج وتجفيفه.
في طريقة كربونات الكالسيوم، يتم تسخين كربونات الكالسيوم أولاً لإنتاج أكسيد الكالسيوم وثاني أكسيد الكربون. تتضمن عملية الترطيب خلط أكسيد الكالسيوم مع الماء، مما ينتج عنه Ca(OH)2.
استخدامات هيدروكسيد الكالسيوم
يستخدم Ca(OH)2 في العديد من الصناعات، بما في ذلك:
- البناء: يستخدم كمكون أساسي في إنتاج الخرسانة والملاط والجص نظراً لقدرته على تقوية هذه المواد وزيادة متانة هذه المواد.
- الزراعة: يستخدم كمحسن للتربة لتقليل حموضة التربة وتحسين خصوبة التربة.
- معالجة المياه: تستخدم لتليين المياه عن طريق إزالة الشوائب مثل أيونات المغنيسيوم والكالسيوم.
- التصنيع الكيميائي: يستخدم في إنتاج المواد الكيميائية المختلفة مثل ستيرات الكالسيوم وهيبوكلوريت الكالسيوم وفوسفات الكالسيوم.
- صناعة المواد الغذائية: يستخدم كمضاف غذائي لتنظيم مستويات الحموضة في المنتجات الغذائية مثل المخللات والزيتون والمشروبات الغازية.
- الصناعة الطبية: يستخدم في إجراءات طب الأسنان المختلفة، مثل علاج قنوات الجذر وحشوات التجاويف، وذلك بسبب خصائصه المضادة للميكروبات والفطريات.
- صناعة اللب والورق: يستخدم في إنتاج الورق لتحسين لمعان الورق وقوته.
- صناعة الجلود: يستخدم في معالجة الجلود لإزالة الشعر والشوائب.
أسئلة:
س: هل هيدروكسيد الكالسيوم قابل للذوبان؟
ج: Ca(OH)2 قابل للذوبان بشكل معتدل في الماء، مع قابلية ذوبان تبلغ حوالي 1.2 جم / لتر في درجة حرارة الغرفة.
س: ما هي صيغة هيدروكسيد الكالسيوم؟
ج: صيغة هيدروكسيد الكالسيوم هي Ca(OH)2.
س: أين يمكنني شراء هيدروكسيد الكالسيوم بالقرب مني؟
ج: يمكن شراء Ca(OH)2 من متاجر المواد الكيميائية أو متاجر الأجهزة أو تجار التجزئة عبر الإنترنت. يمكنك البحث عن متاجر المواد الكيميائية أو متاجر الأجهزة القريبة من منطقتك أو التحقق من تجار التجزئة عبر الإنترنت مثل Amazon أو eBay.
س: هل Ca(OH)2 حمض أم قاعدة؟
ج: Ca(OH)2 عبارة عن قاعدة. وهي قاعدة قوية تتفكك تماما في الماء لتكوين أيونات الكالسيوم (Ca2+) وأيونات الهيدروكسيد (OH-).
س: عندما يحدث التفاعل H3PO4(aq)+Ca(OH)2(aq)→، ما صيغة الملح المتكون؟
ج: التفاعل بين H3PO4(aq) وCa(OH)2(aq) ينتج فوسفات الكالسيوم (Ca3(PO4)2) والماء (H2O) كملح ومنتج ثانوي، على التوالي.
س: هل Ca(OH)2 قابل للذوبان في الماء؟
ج: نعم، Ca(OH)2 قابل للذوبان بشكل معتدل في الماء. يمكن أن يذوب في الماء لتكوين محلول مشبع بتركيز حوالي 1.2 جم / لتر في درجة حرارة الغرفة.
س: هل Ca(OH)2 قاعدة قوية؟
ج: نعم، Ca(OH)2 قاعدة قوية. وهو مركب أساسي للغاية يتفكك تمامًا في الماء ليشكل أيونات Ca2+ وOH-، مما يجعله قاعدة قوية.
س: ما الذي ينتج عندما يتفاعل حمض الهيدروكلوريك مع Ca(OH)2؟
ج: عندما يتفاعل حمض الهيدروكلوريك مع Ca(OH)2، فإن النواتج المتكونة هي كلوريد الكالسيوم (CaCl2) والماء (H2O)، لأن أيونات H+ من HCl تتفاعل مع أيونات OH- من Ca(OH)2 لتكوين الماء، بينما وتشكل أيونات Ca2+ وCl- المتبقية الملح وكلوريد الكالسيوم.
