n-بنتان عبارة عن هيدروكربون له الصيغة الجزيئية C5H12. يتم استخدامه كمذيب ووقود وعامل نفخ لعزل الرغوة. درجة غليانه هي 36 درجة مئوية.
| اسم الأيوباك | البنتان |
| الصيغة الجزيئية | C5H12 |
| CAS رقم | 109-66-0 |
| المرادفات | ن-أميلهيدريد، سكيليسولف أ، هيدريد الأميل، هيدريد البنتيل، رقم الأمم المتحدة 1265 |
| إنتشي | إنشي=1S/C5H12/c1-3-5-4-2/h3-5H2.1-2H3 |
خصائص ن-بنتان
نقطة غليان البنتان
البنتان لديه نقطة غليان تبلغ 36.07 درجة مئوية (97.13 درجة فهرنهايت) عند الضغط القياسي (1 ضغط جوي). وهو سائل متطاير وقابل للاشتعال ويتبخر بسهولة في درجة حرارة الغرفة. نقطة غليانها المنخفضة تجعلها مفيدة كعامل نفخ للرغاوي العازلة وكوقود لمحركات الاحتراق الداخلي.
صيغة البنتان
الصيغة الكيميائية للبنتان هي C5H12. وهو ألكان ذو سلسلة مستقيمة وينتمي إلى المجموعة الهيدروكربونية. تشير الصيغة إلى عدد ونوع الذرات الموجودة في جزيء البنتان. إن صيغة البنتان مهمة في تحديد سلوكه في التطبيقات المختلفة، مثل تفاعله مع المواد الأخرى.
الكتلة المولية للبنتان
الكتلة المولية للبنتان، والتي تسمى أيضًا البنتان العادي، هي 72.15 جم/مول. وهو ألكان ذو سلسلة مستقيمة ويحتوي على خمس ذرات كربون و 12 ذرة هيدروجين. يتم حساب كتلته المولية عن طريق إضافة الأوزان الذرية للكربون والهيدروجين في الجزيء. تعتبر الكتلة المولية للبنتان مهمة في تحديد كمية المركب اللازمة في التفاعلات الكيميائية المختلفة.
نقطة انصهار البنتان
البنتان لديه نقطة انصهار تبلغ -129.8 درجة مئوية (-201.6 درجة فهرنهايت). وهو سائل عديم اللون في درجة حرارة الغرفة والضغط، لكنه يمكن أن يتجمد إلى مادة صلبة عند درجات حرارة منخفضة. تعتبر نقطة انصهار البنتان مهمة في تحديد سلوكه في التطبيقات المختلفة، مثل التبريد ونقل الحرارة.
كثافة البنتان جم/مل
تبلغ كثافة البنتان 0.63 جم / مل عند 20 درجة مئوية. وهو سائل أقل كثافة من الماء، ويطفو على سطح الماء. تعد كثافة البنتان مهمة في تحديد سلوكه في التطبيقات المختلفة، مثل الخلط مع السوائل الأخرى ومدى ملاءمته كوقود.
الوزن الجزيئي للبنتان
الوزن الجزيئي للبنتان هو 72.15 جم / مول. وهو مجموع الأوزان الذرية لجميع الذرات الموجودة في جزيء البنتان. الوزن الجزيئي للبنتان مهم في تحديد سلوكه في التطبيقات المختلفة، مثل قابليته للذوبان في المذيبات المختلفة.
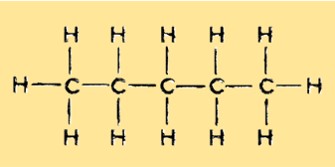
هيكل البنتان
يحتوي البنتان على بنية خطية غير متفرعة تحتوي على خمس ذرات كربون و 12 ذرة هيدروجين. وهو هيدروكربون مشبع وينتمي إلى مجموعة الألكانات. ترتبط كل ذرة كربون بذرتي هيدروجين، باستثناء ذرتي الكربون الطرفيتين المرتبطتين بثلاث ذرات هيدروجين.
| مظهر | سائل عديم اللون |
| جاذبية معينة | 0.626 – 0.63 عند 20 درجة مئوية |
| لون | عديم اللون |
| يشم | رائحة البنزين |
| الكتلة المولية | 72.15 جرام/مول |
| كثافة | 0.63 جم/مل عند 20 درجة مئوية |
| نقطة الانصهار | -129.8 درجة مئوية (-201.6 درجة فهرنهايت) |
| نقطة الغليان | 36.07 درجة مئوية (97.13 درجة فهرنهايت) |
| نقطة فلاش | -49 درجة مئوية (-56.2 درجة فهرنهايت) |
| الذوبان في الماء | 17.5 ملغم/لتر عند 20 درجة مئوية |
| الذوبان | غير قابلة للذوبان في الماء، قابل للذوبان في المذيبات العضوية |
| ضغط البخار | 380 ملم زئبق عند 25 درجة مئوية |
| كثافة بخار | 2.5 (الهواء=1) |
| pKa | ~45 |
| الرقم الهيدروجيني | غير قابل للتطبيق |
السلامة ومخاطر ن-بنتان
إن-بنتان هو سائل قابل للاشتعال ويمكن أن يشكل مخاليط متفجرة مع الهواء. إنه يمثل خطر الحريق والانفجار ويجب التعامل معه بحذر. قد يسبب تهيجًا للعينين والجلد والجهاز التنفسي، كما أن التعرض له لفترات طويلة قد يسبب الدوخة والصداع. من المهم استخدام معدات الحماية الشخصية المناسبة عند التعامل مع ن-بنتان. في حالة نشوب حريق، استخدم عوامل الإطفاء المناسبة، مثل ثاني أكسيد الكربون أو المسحوق الكيميائي الجاف. ومن المهم أيضًا تخزين n-Pentane في منطقة باردة وجيدة التهوية وبعيدًا عن مصادر الاشتعال.
| رموز الخطر | ف، شي |
| وصف الأمان | يُحفظ بعيدًا عن الحرارة/الشرر/اللهب المكشوف/الأسطح الساخنة. استخدم فقط الأدوات التي لا تسبب شرارة. الحفاظ على حاوية مغلقة بإحكام. لا تتنفس الأبخرة. تجنب ملامسة العينين والجلد، والملابس. استخدم فقط في منطقة جيدة التهوية. في حالة نشوب حريق، استخدم عوامل الإطفاء المناسبة. |
| أرقام تعريف الأمم المتحدة | UN1265 |
| رمز النظام المنسق | 2901.10.00 |
| فئة الخطر | 3 |
| مجموعة التعبئة | ثانيا |
| تسمم | قد يسبب العين والجلد وتهيج الجهاز التنفسي. التعرض لفترات طويلة قد يسبب الدوخة والصداع. |
طرق لتخليق ن-بنتان
تكرير النفط هو الطريقة الأساسية لإنتاج البنتان. وهو عبارة عن هيدروكربون ذو سلسلة مستقيمة وأحد المكونات الرئيسية للبنزين. هناك عدة طرق لتخليق n-Pentane:
تكسير النفط: للحصول على البنتان من النفط، يمكننا تكسيره باستخدام التقطير التجزيئي، وهي عملية يتم فيها تسخين النفط الخام لفصل مكوناته بناءً على درجة غليانها. يمكننا بعد ذلك فصل البنتان n عن الهيدروكربونات الأخرى التي تتراوح درجة غليانها بين 30 و40 درجة مئوية.
الأيزومرية: الأيزومرية هي عملية تحويل أحد الهيدروكربونات إلى صيغة أخرى لها نفس الجزيئي ولكن بنية مختلفة. تنتج أيزومرة البنتين n- بنتان كمنتج ثانوي. تستخدم صناعة البتروكيماويات عادة هذه الطريقة.
الهدرجة: هدرجة البنتين هي طريقة أخرى لتخليق البنتان. لتصنيع البنتان n من البنتين، يمكننا التفاعل مع غاز الهيدروجين في وجود محفز، والذي عادة ما يكون معدن مثل النيكل أو البلاتين. ينتج عن التفاعل n-بنتان كمنتج ثانوي.
تجفيف 1-بنتانول: يمكن أيضًا تصنيع ن-بنتان من 1-بنتانول عن طريق تجفيفه باستخدام محفز حمضي مثل حمض الكبريتيك . ينتج عن هذا التفاعل ن-بنتين، والذي يمكن بعد ذلك هدرجته للحصول على ن-بنتان.
استخدامات ن-بنتان
للبنتان N استخدامات مختلفة في مختلف الصناعات. فيما يلي بعض التطبيقات الرئيسية:
- المذيب: يستخدم كمذيب للزيوت والشموع والراتنجات في صناعة الطلاء والطلاء. تستخدمه المواد اللاصقة والأحبار والمطاط كمذيب.
- عامل النفخ: يستخدم كعامل نفخ في إنتاج المواد العازلة الرغوية، مثل البوليسترين الممدد (EPS) والبوليسترين المبثوق (XPS).
- الوسيط الكيميائي: يستخدم كمادة كيميائية وسيطة في إنتاج مواد كيميائية أخرى، مثل البنتانول وحمض البنتانويك والبنتانال.
- الوقود: يستخدم كوقود في بعض خلطات البنزين، وعادةً ما يكون أحد مكونات الخلط لزيادة مستويات الأوكتان.
- معيار المعايرة: يستخدم كمعيار معايرة في كروماتوغرافيا الغاز.
- الاستخلاص: يستخدم في استخلاص الزيوت الصالحة للأكل، مثل زيت فول الصويا، وفي استخلاص المنتجات الطبيعية، مثل الزيوت العطرية من النباتات.
- الأبحاث المخبرية: يستخدم في الأبحاث المخبرية كمذيب وكمادة مرجعية للكروماتوغرافيا الغازية.
أسئلة:
س: الصيغة الجزيئية للبنتان هي c5h12. ما هي الصيغة الجزيئية لأيزومر البنتان؟
ج: 2-ميثيل بيوتان (المعروف أيضًا باسم الأيزوبنتان) له الصيغة الجزيئية C5H12 وهو أيزومر للبنتان.
س: هل البنتان قطبي؟
ج: لا، البنتان غير قطبي لأنه يحتوي فقط على روابط كربون-كربون غير قطبية وروابط كربون-هيدروجين وله شكل جزيئي متماثل.
س: أي مما يلي هو الأكثر قابلية للذوبان في الماء؟ حمض الخليك البنتانول حمض البيوتانويك البنتانال
ج: حمض الأسيتيك هو الأكثر قابلية للذوبان في الماء بسبب قدرته على تكوين روابط هيدروجينية مع جزيئات الماء.
س: هل البنتان قابل للذوبان في الماء؟
ج: لا، البنتان غير قابل للذوبان في الماء بسبب طبيعته غير القطبية وعدم قدرته على تكوين روابط هيدروجينية مع جزيئات الماء.
س: هل يحتوي ن-بنتان على رابطة هيدروجينية؟
ج: لا، لا يحتوي البنتان n على رابطة هيدروجينية لأنه يفتقر إلى ذرات هيدروجين مرتبطة بذرات سالبية كهربية مثل الأكسجين أو النيتروجين أو الفلور.
