نترات النيكل (Ni(NO₃)₂) هو مركب كيميائي يحتوي على أيونات النيكل والنترات. وهو قابل للذوبان في الماء وغالباً ما يستخدم في المحفزات والطلاء الكهربائي وكمقدمة في مركبات النيكل الأخرى.
| اسم الأيوباك | ثنائي نترات النيكل |
| الصيغة الجزيئية | ني (NO₃)₂ |
| CAS رقم | 13138-45-9 |
| المرادفات | نترات النيكل (II)، نترات النيكل، ثنائي نيترونيكل، مكرر النيكل (نترات) |
| إنتشي | إنتشي = 1S/2NO3.Ni/c2 2-1(3)4;/q2 -1;+2 |
خصائص نترات النيكل
صيغة نترات النيكل
الصيغة الكيميائية لثنائي نترات النيكل هي Ni(NO₃)₂. وهو يمثل مركبًا يتكون من كاتيونات النيكل (Ni) وأنيونات النترات (NO₃). ويشير الحرف “2” في الصيغة إلى وجود أيونين NO3- لكل كاتيون Ni+2.
نترات النيكل الكتلة المولية
يمكن حساب الكتلة المولية لثنائي نترات النيكل عن طريق إضافة الكتل الذرية للعناصر المكونة له. النيكل (Ni) لديه كتلة مولية تبلغ حوالي 58.69 جم / مول، بينما النترات (NO₃) لديها كتلة مولية تبلغ حوالي 62.00 جم / مول. وبجمعهما معًا، تبلغ الكتلة المولية لثنائي نترات النيكل حوالي 182.69 جم/مول.
درجة غليان نترات النيكل
تشير نقطة غليان ثنائي نترات النيكل إلى درجة الحرارة التي يتحول عندها من سائل إلى غاز. تبلغ نقطة غليان ثنائي نترات النيكل حوالي 136.7 درجة مئوية (278.06 درجة فهرنهايت). ومع ذلك، من الضروري ملاحظة أن هذه القيمة قد تختلف قليلاً اعتمادًا على نقاء المركب.
نقطة انصهار نترات النيكل
نقطة انصهار ثنائي نترات النيكل هي درجة الحرارة التي يتحول عندها من الحالة الصلبة إلى الحالة السائلة. تبلغ نقطة انصهار ثنائي نترات النيكل حوالي 56.7 درجة مئوية (134.06 درجة فهرنهايت). مثل نقطة الغليان، يمكن أن تتأثر نقطة الانصهار بنقاء المركب.
كثافة نترات النيكل جم / مل
كثافة ثنائي نترات النيكل هي مقياس لكتلته لكل وحدة حجم. تبلغ كثافة ثنائي نترات النيكل حوالي 1.68 جم / مل. تشير هذه القيمة إلى أنه أكثر كثافة من الماء الذي تبلغ كثافته 1 جم/مل.
الوزن الجزيئي لنترات النيكل
الوزن الجزيئي لثنائي نترات النيكل هو مجموع الأوزان الذرية لجميع الذرات الموجودة في صيغته الكيميائية. كما ذكرنا سابقًا، يبلغ الوزن الجزيئي لثنائي نترات النيكل حوالي 182.69 جم/مول.
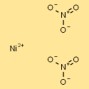
هيكل نترات النيكل
يمكن تصور بنية ثنائي نترات النيكل على شكل كاتيونات نيكل (Ni²⁺) محاطة باثنين من أنيونات النترات (NO₃⁻) لكل كاتيون. تشكل أيونات النترات روابط منسقة مع كاتيونات النيكل، مما يؤدي إلى تكوين مركب أيوني مستقر.
ذوبان نترات النيكل
ثنائي نترات النيكل قابل للذوبان بشدة في الماء ويشكل محلولًا أزرقًا مخضرًا واضحًا. تعتبر قابليته للذوبان في الماء خاصية أساسية، حيث تتيح استخدامه بسهولة في تطبيقات مختلفة، مثل المحفزات والطلاء الكهربائي وإنتاج مركبات النيكل الأخرى.
| مظهر | صلبة زرقاء مخضرة |
| جاذبية معينة | 1.68 جرام/مل |
| لون | ازرق مخضر |
| يشم | عديم الرائحة |
| الكتلة المولية | 182.69 جرام/مول |
| كثافة | 1.68 جرام/مل |
| نقطة الانصهار | 56.7 درجة مئوية |
| نقطة الغليان | 136.7 درجة مئوية |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان للغاية |
| الذوبان | قابل للذوبان في الماء والمذيبات العضوية مثل الإيثانول |
| ضغط البخار | غير متاح |
| كثافة بخار | غير متاح |
| pKa | غير متاح |
| الرقم الهيدروجيني | محايد (حوالي 7) |
يرجى ملاحظة أن بعض الخصائص قد لا تكون متاحة أو ذات صلة بثنائيات النيكل.
السلامة ومخاطر نترات النيكل
يشكل ثنائي نترات النيكل بعض مخاطر السلامة ويجب توخي الحذر عند التعامل معه. الاتصال المباشر مع المركب قد يسبب تهيج الجلد والعين. استنشاق غبارها أو أبخرتها قد يسبب تهيج الجهاز التنفسي. ومن الضروري ارتداء معدات الحماية المناسبة، مثل القفازات ونظارات السلامة، عند العمل مع ثنائي نترات النيكل. تجنب تناوله لأنه قد يكون ضارًا بالصحة. في حالة التعرض العرضي، اطلب العناية الطبية على الفور. بالإضافة إلى ذلك، يعد التخزين المناسب في منطقة جيدة التهوية، بعيدًا عن المواد غير المتوافقة، أمرًا بالغ الأهمية لتقليل المخاطر المحتملة وضمان التعامل الآمن.
| رموز الخطر | تآكل، مهيج، خطر على الصحة |
| وصف الأمان | يسبب تهيج الجلد والعين. ضار إذا تم استنشاقه أو ابتلاعه. التعامل مع الرعاية. تجنب الاتصال المباشر. استخدم معدات الحماية. |
| أرقام تعريف الأمم المتحدة | UN2724 |
| رمز النظام المنسق | 2834.2990 |
| فئة الخطر | 5.1 (المواد المؤكسدة) |
| مجموعة التعبئة | ثانيا |
| تسمم | سامة إلى حد ما |
طرق تصنيع نترات النيكل
هناك عدة طرق لتجميع ثنائي نترات النيكل. تتضمن الطريقة الشائعة التفاعل بين أكسيد النيكل (NiO) أو هيدروكسيد النيكل (Ni(OH)₂) مع حمض النيتريك (HNO₃). خلال هذه العملية، يذوب أكسيد النيكل أو هيدروكسيد النيكل في حمض النيتريك، مما يؤدي إلى تكوين ثنائي نترات النيكل والماء كمنتجات ثانوية.
يمكن أن يأخذ رد الفعل التمثيل التالي:
- مع أكسيد النيكل: NiO + 2HNO₃ → Ni(NO₃)₂ + H₂O
- مع هيدروكسيد النيكل: Ni(OH)₂ + 2HNO₃ → Ni(NO₃)₂ + 2H₂O
هناك طريقة أخرى تتضمن التفاعل بين النيكل المعدني وحمض النيتريك المركز، مما يؤدي إلى تكوين ثنائي نترات النيكل وغاز ثاني أكسيد النيتروجين (NO₂) كمنتج ثانوي:
- مع معدن النيكل: Ni + 4HNO₃ → Ni(NO₃)₂ + 2H₂O + 2NO₂
من المهم إجراء هذه التفاعلات تحت ظروف خاضعة للتحكم جيدًا لأن حمض النيتريك عامل مؤكسد قوي ويمكن أن يكون خطيرًا. ضمان نتيجة آمنة وناجحة أثناء عملية التوليف من خلال الاستخدام الفعال لتدابير ومعدات السلامة المناسبة. بالإضافة إلى ذلك، قد يختلف اختيار الكواشف وظروف التفاعل اعتمادًا على التطبيق المحدد والخصائص المطلوبة لمنتج ثنائي نترات النيكل.
استخدامات نترات النيكل
يجد ثنائي نترات النيكل تطبيقات متعددة في مختلف الصناعات بسبب خصائصه الفريدة. فيما يلي بعض استخداماته الرئيسية:
- الطلاء الكهربائي: يسمح ثنائي نترات النيكل بترسيب طبقة رقيقة من النيكل على المعادن المختلفة، مما يحسن مقاومتها للتآكل ومظهرها أثناء عمليات الطلاء الكهربائي.
- المحفز: يلعب دوراً حاسماً كمحفز في التفاعلات الكيميائية، مما يسهل تحويل المواد المتفاعلة إلى المنتجات المطلوبة، وخاصة في التخليق العضوي.
- السيراميك: تستخدم صناعة السيراميك ثنائي نترات النيكل لإضفاء ألوان محددة وتحسين أداء المواد الخزفية.
- صناعة الزجاج: يستخدم المصنعون في صناعة الزجاج ثنائي نترات النيكل لإنتاج زجاج ملون ذو خصائص بصرية مرغوبة.
- إنتاج البطاريات: يستخدم المصنعون ثنائي نترات النيكل في إنتاج البطاريات القائمة على النيكل، بما في ذلك بطاريات هيدريد معدن النيكل (NiMH).
- خلايا الوقود: يعمل ثنائي نترات النيكل كمقدمة في تصنيع أقطاب أكسيد النيكل لخلايا وقود الأكسيد الصلب (SOFCs).
- الألعاب النارية: في الألعاب النارية، يعمل ثنائي نترات النيكل كعامل مؤكسد، وينتج لهبًا أخضر في الألعاب النارية.
- الكواشف الكيميائية: تعمل ككاشف في التفاعلات الكيميائية المختلفة، خاصة تلك التي تتضمن معقدات النيكل.
- الأسمدة: في الزراعة، يستخدم ثنائي نترات النيكل أحيانًا كمصدر للنيكل في الأسمدة لمعالجة نقص النيكل في بعض المحاصيل.
تسلط التطبيقات المتنوعة لثنائي نترات النيكل في مختلف الصناعات الضوء على أهميته كمركب متعدد الاستخدامات مع مجموعة واسعة من الاستخدامات العملية.
أسئلة:
س: عند خلط محاليل فوسفات الأمونيوم ونترات النيكل (ii) ما الذي يترسب؟
ج: يترسب فوسفات النيكل (II).
س: ما مولارية المحلول الذي يحتوي على 5.8 جرام من نترات النيكل في 500 مل؟
ج: المولارية 0.2 م.
س: ما هي الأطوال الموجية التي تمتصها نترات النيكل؟
ج: يمتص ثنائي نترات النيكل الأطوال الموجية في المناطق فوق البنفسجية والمرئية.
س: هل نترات النيكل II قابلة للذوبان؟
ج: نعم، ثنائي نترات النيكل (II) قابل للذوبان في الماء.
س: ما هي صيغة نترات النيكل II؟
ج: الصيغة هي Ni(NO₃)₂.
س: ما هو لون نترات النيكل II؟
ج: لون ثنائي نترات النيكل (II) أزرق مخضر.
س: ما عدد ذرات النيتروجين الموجودة في الصيغة الكيميائية Ni(NO₃)₂؟
ج: هناك أربع ذرات نيتروجين.
س: هل Ni(NO₃)₂ قابل للذوبان في الماء؟
ج: نعم، Ni(NO₃)₂ قابل للذوبان في الماء.
س: أي من المركبات C4H10، BaCl2، Ni(NO₃)₂، SF6 يجب أن توجد كوحدات صيغة؟
ج: يجب أن يكون C4H10 (البيوتان) وSF6 (سداسي فلوريد الكبريت) موجودين كوحدات صيغة. BaCl2 وNi(NO₃)₂ عبارة عن مركبات أيونية.
