نترات الصوديوم (NaNO3) هو مركب شائع الاستخدام في صناعة الأغذية كمادة حافظة. كما أنه يستخدم في الأسمدة والمتفجرات بسبب خصائصه المؤكسدة.
| اسم الأيوباك | نترات الصوديوم |
| الصيغة الجزيئية | نانو3 |
| CAS رقم | 7631-99-4 |
| المرادفات | الملح الصخري التشيلي، مكعب نيتر، ملح الصوديوم |
| إنتشي | InChI=1S/NO3.Na/c2-1(3)4;/q-1;+1 |
خصائص نترات الصوديوم
صيغة نترات الصوديوم
الصيغة الكيميائية لنترات الصوديوم هي NaNO3. تمثل الصيغة عدد وأنواع الذرات التي تشكل جزيء نترات الصوديوم. وهذا يدل على أن كل جزيء من نترات الصوديوم يحتوي على ذرة صوديوم واحدة، وذرة نيتروجين واحدة، وثلاث ذرات أكسجين. الصيغة مهمة لفهم الخواص الكيميائية لنترات الصوديوم واستخدامها في التطبيقات المختلفة.
نترات الصوديوم الكتلة المولية
NaNO3 لديه كتلة مولية تبلغ 84.9947 جم / مول. الكتلة المولية هي كتلة مول واحد من المادة ويتم حسابها عن طريق إضافة الكتل الذرية لجميع الذرات الموجودة في الجزيء. يحتوي NaNO3 على ذرة Na واحدة وذرة N واحدة وثلاث ذرات O. الكتل الذرية لهذه الذرات هي 22.98977 جم/مول للصوديوم، 14.00674 جم/مول للنيتروجين و15.9994 جم/مول للأكسجين. ولذلك، يتم حساب الكتلة المولية لـ NaNO3 على النحو التالي:
الكتلة المولية = (1 × 22.98977) + (1 × 14.00674) + (3 × 15.9994) = 84.9947 جم / مول
درجة غليان نترات الصوديوم
نقطة غليان NaNO3 هي 380 درجة مئوية (716 درجة فهرنهايت). نقطة الغليان هي درجة الحرارة التي تتحول عندها المادة من سائل إلى غاز عند الضغط الجوي. NaNO3 هو مركب أيوني ذو قوى جزيئية قوية تربط جزيئاته ببعضها البعض. تتطلب هذه القوى بين الجزيئات كمية كبيرة من الطاقة لكسرها، ولهذا السبب تكون نقطة غليان NaNO3 مرتفعة نسبيًا.
نقطة انصهار نترات الصوديوم
NaNO3 لديه نقطة انصهار تبلغ 308 درجة مئوية (586 درجة فهرنهايت). نقطة الانصهار هي درجة الحرارة التي تتحول عندها المادة من الحالة الصلبة إلى الحالة السائلة عند الضغط الجوي. NaNO3 هو مركب أيوني له بنية بلورية ذات روابط أيونية قوية بين جزيئاته. تتطلب هذه الروابط كمية كبيرة من الطاقة لكسرها، ولهذا السبب تكون درجة انصهار NaNO3 عالية نسبيًا.
كثافة نترات الصوديوم جم/مل
تبلغ كثافة NaNO3 2.257 جم/مل. الكثافة هي الكتلة لكل وحدة حجم المادة. NaNO3 عبارة عن مادة صلبة بلورية بيضاء ذات كثافة عالية نسبيًا بسبب جزيئاتها المتراصة بإحكام. ومن المهم أن نلاحظ أن كثافة NaNO3 يمكن أن تختلف تبعا لعوامل مثل درجة الحرارة والضغط.
الوزن الجزيئي لنترات الصوديوم
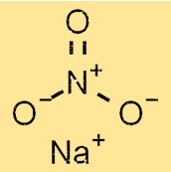
الوزن الجزيئي لـ NaNO3 هو 84.9947 جم/مول. الوزن الجزيئي هو مجموع الأوزان الذرية لجميع الذرات الموجودة في الجزيء. كما ذكرنا سابقًا، يحتوي NaNO3 على ذرة صوديوم واحدة، وذرة نيتروجين واحدة، وثلاث ذرات أكسجين، مما يساهم في وزنه الجزيئي.
هيكل نترات الصوديوم
يحتوي NaNO3 على بنية بلورية تتكون من أيونات Na+ وNO3-. يتم ترتيب كاتيونات Na+ وأنيونات NO3- في بنية شبكية متماسكة معًا بواسطة روابط أيونية قوية. يعد هيكل NaNO3 مهمًا لفهم خصائصه الفيزيائية والكيميائية.
| مظهر | بلورات بيضاء أو مسحوق |
| جاذبية معينة | 2,257 جم/سم3 عند 20 درجة مئوية |
| لون | عديم اللون |
| يشم | عديم الرائحة |
| الكتلة المولية | 84.9947 جرام/مول |
| كثافة | 2,257 جم/سم3 عند 20 درجة مئوية |
| نقطة الانصهار | 308 درجة مئوية (586 درجة فهرنهايت) |
| نقطة الغليان | 380 درجة مئوية (716 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | 87 جم/100 مل (20 درجة مئوية) |
| الذوبان | قابل للذوبان في الجلسرين والأمونيا وبيروكسيد الهيدروجين. غير قابل للذوبان في الكحول. |
| ضغط البخار | 0.003 ملم زئبق عند 20 درجة مئوية |
| كثافة بخار | غير قابل للتطبيق |
| pKa | -1.4 |
| الرقم الهيدروجيني | 7 (محلول 10% في الماء) |
سلامة ومخاطر نترات الصوديوم
يمكن أن يشكل NaNO3 العديد من المخاطر على صحة الإنسان والبيئة. إنه مهيج خفيف وقد يسبب تهيج الجلد والعين عند ملامسته. استنشاق غبار NaNO3 قد يسبب أيضًا تهيجًا في الجهاز التنفسي. قد يتفاعل NaNO3 مع المواد القابلة للاحتراق ويسبب حريقًا أو انفجارًا. كما أنه سام للحياة المائية ويجب عدم إطلاقه في المجاري المائية. يجب التعامل مع NaNO3 بعناية ويجب ارتداء معدات الحماية المناسبة عند التعامل معه. يجب أن يتم تخزينه في منطقة جافة وجيدة التهوية بعيدا عن المواد غير المتوافقة. وينبغي أيضًا اتباع طرق التخلص المناسبة لتجنب تلوث البيئة.
| رموز الخطر | أوه شي |
| وصف الأمان | تجنب ملامسة المواد القابلة للاحتراق، وارتداء معدات الحماية وتخزينها في منطقة جافة وجيدة التهوية. التخلص منها بشكل سليم. |
| أرقام تعريف الأمم المتحدة | UN1498 (لا مائي) / UN1499 (منصهر) |
| رمز النظام المنسق | 28342910 |
| فئة الخطر | 5.1 (عامل مؤكسد) |
| مجموعة التعبئة | ثالثا |
| تسمم | الجرعة المميتة 50 (عن طريق الفم، للفئران): 1260 ملغم/كغم |
طرق تصنيع نترات الصوديوم
يمكن لطرق عديدة تصنيع NaNO3، بما في ذلك تفاعل حمض النيتريك مع هيدروكسيد الصوديوم أو تفاعل حمض النيتريك مع كربونات الصوديوم .
تتضمن الطريقة الأولى إضافة محلول هيدروكسيد الصوديوم تدريجياً إلى محلول حمض النيتريك مع التحريك حتى يصل الرقم الهيدروجيني إلى 7-8. ويتفاعل المحلول ليشكل NaNO3 الذي يستطيع الإنسان تبخيره وتبلوره للحصول على المركب الصلب.
تتضمن الطريقة الأخرى تفاعل كربونات الصوديوم مع حمض النيتريك . يضيف الشخص كربونات الصوديوم إلى حامض النتريك حتى يتوقف الفوران، ثم يسخن الخليط حتى يتوقف إطلاق ثاني أكسيد الكربون. ثم تتبخر وتبلور المحلول الذي تم الحصول عليه للحصول على NaNO3.
يمكن أن يؤدي إنتاج NaNO3 إلى الحصول عليه كمنتج ثانوي عن طريق إنتاج حمض النيتريك أو عن طريق أكسدة الأمونيا بمحفز البلاتين.
استخدامات نترات الصوديوم
NaNO3 لديه مجموعة واسعة من التطبيقات الصناعية والزراعية والطبية بسبب خصائصه الكيميائية والفيزيائية. بعض استخدامات NaNO3 تشمل:
- الأسمدة: يستخدم عادة كسماد نيتروجيني في الزراعة بسبب قابليته العالية للذوبان وخصائص الإطلاق السريع.
- المواد الحافظة للأغذية: تستخدم كمادة حافظة للأغذية لمنع نمو البكتيريا والفطريات في اللحوم المصنعة مثل لحم الخنزير ولحم الخنزير المقدد والنقانق.
- إنتاج الزجاج: يستخدم كتدفق في إنتاج الزجاج لخفض درجة انصهاره وتحسين نقاءه.
- الألعاب النارية: عنصر رئيسي في إنتاج الألعاب النارية وأجهزة الألعاب النارية الأخرى بسبب خصائصها المؤكسدة.
- سائل نقل الحرارة: يستخدم كمائع نقل الحرارة في محطات الطاقة الشمسية لتخزين ونقل الطاقة الحرارية.
- التطبيقات الطبية: يستخدم في علاج الذبحة الصدرية، وهي حالة قلبية تسبب آلام في الصدر بسبب عدم تدفق الدم بشكل كاف إلى القلب.
- التطبيقات الصناعية: يستخدم أيضًا في إنتاج الأصباغ والمبيضات والمواد الكيميائية الأخرى.
الأسئلة :
س: هل نترات الصوديوم قابلة للذوبان في الماء؟
ج: نعم، NaNO3 قابل للذوبان بدرجة عالية في الماء، حيث تبلغ قابليته للذوبان 91 جرامًا لكل 100 ملليلتر من الماء في درجة حرارة الغرفة.
س: ما هو استخدام نترات الصوديوم؟
ج: يستخدم NaNO3 في مجموعة متنوعة من الأغراض بما في ذلك الأسمدة والمواد الحافظة الغذائية وإنتاج الزجاج وأكسدة الألعاب النارية وسائل نقل الحرارة وفي التطبيقات الطبية والصناعية.
س: هل نترات الصوديوم إلكتروليت قوي؟
ج: نعم، NaNO3 عبارة عن إلكتروليت قوي، مما يعني أنه يتفكك تمامًا إلى أيونات عندما يذوب في الماء، مما يسمح بتوصيل الكهرباء.
س: هل NaNO3 قابل للذوبان في الماء؟
ج: نعم، NaNO3 قابل للذوبان بدرجة عالية في الماء، حيث تبلغ قابليته للذوبان 91 جرامًا لكل 100 ملليلتر من الماء في درجة حرارة الغرفة.
س: هل NaNO3 قابل للذوبان؟
ج: نعم، NaNO3 قابل للذوبان في الماء، لكنه غير قابل للذوبان في بعض المذيبات العضوية مثل الإيثانول والأثير.
س: ما الملح الذي ينتج عندما يتفاعل NH4OH مع HNO3؟ KNO2 أو NaNO3 أو NH4NO3 أو NH4NO2؟
ج: الملح الناتج عندما يتفاعل NH4OH مع HNO3 هو NH4NO3، المعروف أيضًا باسم نترات الأمونيوم.
س: هل NaNO3 حمض أم قاعدة؟
ج: NaNO3 مركب متعادل وليس حمضا ولا قاعدة.
س: ما هو NaNO3؟
ج: NaNO3 هي الصيغة الكيميائية لنترات الصوديوم، وهي مادة صلبة بلورية بيضاء لها تطبيقات صناعية وزراعية وطبية مختلفة.
