نترات الباريوم (Ba(NO3)2) مادة صلبة بيضاء اللون. يذوب في الماء ويشكل أيونات الباريوم والنترات. وقد تنفجر عند تسخينها أو خلطها بالوقود.
| اسم الأيوباك | ثنائي نترات الباريوم |
| الصيغة الجزيئية | با(NO3)2 |
| CAS رقم | 10022-31-8 |
| المرادفات | نترات الباريوم، ثنائي نترات الباريوم، ثنائي نترات الباريوم، CQ9625000، (نيتروكسي) نترات الباريو |
| إنتشي | إنتشي=1S/Ba.2NO3/c;2 2-1(3)4/q+2;2 -1 |
خصائص نترات الباريوم
صيغة نترات الباريوم
الصيغة الجزيئية لنترات الباريوم هي Ba(NO3)2. يوضح أن جزيء نترات الباريوم يتكون من ذرة باريوم واحدة وجزيئين نترات. يحمل أيون النترات شحنة -1 وأيون الباريوم لديه شحنة +2، لذا يتحدان بنسبة 1:2 لتكوين مركب متعادل.
نترات الباريوم الكتلة المولية
الكتلة المولية لـ Ba(NO3)2 هي 261.337 جم/مول. هي كتلة مول واحد من جزيئات Ba(NO3)2. لحساب ذلك، عليك إضافة الكتل الذرية لجميع الذرات في الصيغة:
الكتلة المولية لـ Ba(NO3)2 = (1 × 137.327) + (2 × 14.007) + (6 × 15.999) = 261.337 جم/مول
درجة غليان نترات الباريوم
درجة غليان Ba(NO3)2 هي 83 درجة مئوية. هذه هي درجة الحرارة التي يتحول عندها Ba(NO3)2 من الحالة السائلة إلى الحالة الغازية. ومع ذلك، فإن Ba(NO3)2 يتحلل قبل أن يصل إلى درجة غليانه، لذا لا يمكن غليه دون تحلله إلى مواد أخرى.
نقطة انصهار نترات الباريوم
درجة انصهار Ba(NO3)2 هي 592 درجة مئوية. هذه هي درجة الحرارة التي يتحول عندها Ba(NO3)2 من الحالة الصلبة إلى الحالة السائلة. Ba(NO3)2 عبارة عن مادة صلبة بلورية بيضاء عند درجة حرارة وضغط الغرفة، ولكنها تنصهر عند تسخينها فوق نقطة انصهارها.
كثافة نترات الباريوم جم/مل
كثافة Ba(NO3)2 هي 3.23 جم/مل. هذه هي الكتلة لكل وحدة حجم Ba(NO3)2. لحسابها، يجب عليك قسمة كتلة عينة Ba(NO3)2 على حجمها:
كثافة Ba(NO3)2 = الكتلة / الحجم
على سبيل المثال، إذا كانت لدينا عينة بحجم 10 جم من Ba(NO3)2 وحجمها 3.1 مل، فإن كثافتها هي:
كثافة Ba(NO3)2 = 10 / 3.1 = 3.23 جم/مل
الوزن الجزيئي لنترات الباريوم
الوزن الجزيئي لـ Ba(NO3)2 هو نفس كتلته المولية، وهي 261.337 جم/مول. هي كتلة مول واحد من جزيئات Ba(NO3)2. في بعض الأحيان يتم استخدام مصطلح الوزن الجزيئي بالتبادل مع الكتلة المولية، لكنهما ليسا متطابقين تمامًا. يشير الوزن الجزيئي إلى متوسط كتلة جزيء المادة، بينما تشير الكتلة المولية إلى كتلة المول من المادة.
هيكل نترات الباريوم
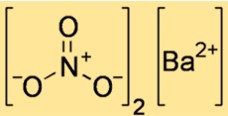
يوضح هيكل Ba(NO3)2 كيفية ترتيب الذرات والأيونات في الفضاء. Ba(NO3)2 هو مركب أيوني، مما يعني أنه يتكون من أيونات الباريوم موجبة الشحنة وأيونات النترات سالبة الشحنة والتي يتم ربطها معًا بواسطة قوى كهروستاتيكية. يمكن تمثيل بنية Ba(NO3)2 بخلية وحدة، وهي أصغر وحدة متكررة توضح ترتيب الأيونات في الشبكة البلورية.
تحتوي الخلية الوحدة من Ba(NO3)2 على شكل مكعب، مع وجود أيون باريوم في كل زاوية وأيون نترات في مركز كل وجه. الرقم التنسيقي لكل أيون هو ستة، مما يعني أن كل أيون محاط بستة أيونات مشحونة بشكل معاكس. ويبلغ طول كل حافة من خلية الوحدة 0.65 نانومتر.
ذوبان نترات الباريوم
قابلية ذوبان Ba(NO3)2 هي كمية Ba(NO3)2 التي يمكن أن تذوب في كمية معينة من المذيب، عادة الماء. تعتمد القابلية للذوبان على عدة عوامل، مثل درجة الحرارة والضغط ووجود مواد أخرى في المحلول.
عند 20 درجة مئوية والضغط الجوي، تبلغ قابلية ذوبان Ba(NO3)2 في الماء حوالي 34 جم لكل 100 مل. وهذا يعني أن 34 جم من Ba(NO3)2 يمكن أن تذوب في 100 مل من الماء في ظل هذه الظروف. تزداد الذوبان مع زيادة درجة الحرارة وتقل مع زيادة الضغط.
Ba(NO3)2 قابل للذوبان أيضًا في المذيبات الأخرى، مثل الإيثانول والأسيتون والميثانول، ولكنه أقل قابلية للذوبان في الماء.
| مظهر | الصلبة البيضاء |
| كثافة محددة | 3.23 |
| لون | عديم اللون، فضي أو رمادي |
| يشم | عديم الرائحة |
| الكتلة المولية | 261,337 جم/مول |
| كثافة | 3.23 جرام/مل |
| نقطة الانصهار | 592 درجة مئوية |
| نقطة الغليان | 83 درجة مئوية |
| نقطة فلاش | غير قابل للاشتعال |
| الذوبان في الماء | 34 جم لكل 100 مل عند 20 درجة مئوية |
| الذوبان | قابل للذوبان في الإيثانول والأسيتون والميثانول. غير قابلة للذوبان في الأثير والكلوروفورم |
| ضغط البخار | ضئيلة |
| كثافة بخار | غير قابل للتطبيق |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | غير متاح |
سلامة ومخاطر نترات الباريوم
Ba(NO3)2 مادة سامة ومؤكسدة. يمكن أن يؤذيك إذا ابتلعته أو تنفسته. هذا يمكن أن يهيج العينين والجلد والجهاز التنفسي. يمكن أن يسبب Ba(NO3)2 أيضًا تشنجات عضلية ومشاكل في القلب والوفاة. يجب عليك تجنب الاتصال بـ Ba(NO3)2 وارتداء معدات الحماية عند التعامل معه. يجب عليك أيضًا إبعاده عن الحرارة والشرر واللهب والمواد القابلة للاحتراق. إذا تعرضت لـ Ba(NO3)2، فيجب عليك غسل عينيك وجلدك بالماء وطلب الرعاية الطبية. يمكنك أيضًا تناول أملاح الكبريتات لتقليل سمية الباريوم.
| رموز الخطر | O (مؤكسد)، Xn (ضار) |
| وصف الأمان | S13: الابتعاد عن الأطعمة والمشروبات، بما في ذلك الحيوانات. S17: يحفظ بعيدا عن المواد القابلة للاحتراق. S22: لا تتنفس الغبار. S26: في حالة ملامسة العينين، اشطفهما فورًا بالكثير من الماء واستشر الطبيب. S36/37/39: ارتد الملابس الواقية المناسبة والقفازات وأدوات حماية العين/الوجه. |
| أرقام تعريف الأمم المتحدة | UN1446 |
| رمز النظام المنسق | 2834 29 10 |
| فئة الخطر | 5.1 (المواد المؤكسدة) |
| مجموعة التعبئة | ثالثا |
| تسمم | الجرعة المميتة 50 (عن طريق الفم، الفئران) = 355 ملغم/كغم؛ التركيز المميت النصفي (الاستنشاق، الفئران) = 0.15 ملغم/لتر/4 ساعات |
طرق تصنيع نترات الباريوم
يمكن استخدام طرق مختلفة لتكوين Ba(NO3)2، وهي مادة صلبة بيضاء اللون.
تتضمن إحدى الطرق تفاعل كربونات الباريوم مع حمض النيتريك . وينتج عن ذلك Ba(NO3)2 وثاني أكسيد الكربون. قم بتصفية محلول Ba(NO3)2 لإزالة أي شوائب حديدية، ثم قم بتبخيره للحصول على بلورات صلبة.
هناك طريقة أخرى وهي تفاعل كبريتيد الباريوم مع حمض النيتريك . وينتج عن ذلك Ba(NO3)2 وكبريتيد الهيدروجين. لتنقية وبلورة محلول Ba(NO3)2، نتبع نفس العملية السابقة.
الطريقة الثالثة تتضمن إذابة معدن الباريوم أو أكسيد الباريوم في حمض النيتريك . وينتج عن ذلك Ba(NO3)2 والهيدروجين أو الماء. يتم بعد ذلك تركيز المحلول المحتوي على Ba(NO3)2 وإخضاعه للتبلور.
الطريقة الرابعة هي استخدام تخليق الملح المنصهر. يتضمن ذلك تسخين خليط من Ba(NO3)2 ومانع غير عضوي، مثل كلوريد الأمونيوم، أو بيكربونات الصوديوم، أو نتريت الصوديوم. يتحلل النافذ ويخلق مسامًا في بلورات Ba(NO3)2. وهذا يجعلها أكثر موثوقية كمؤكسدات للألعاب النارية.
فيما يلي بعض طرق تصنيع Ba(NO3)2. جميعهم يستخدمون حمض النيتريك كمتفاعل مشترك وينتجون Ba(NO3)2 كمنتج.
استخدامات نترات الباريوم
بعض استخدامات Ba(NO3)2 هي:
- مركبات أكسيد الباريوم – تستخدم في إنتاج المواد التي تحتوي على أكسيد الباريوم، مثل السيراميك والزجاج وأنابيب أشعة الكاثود.
- اللهب الأخضر – يستخدم في إشارات المرور الخضراء والألعاب النارية لأنه يحترق بلهب أخضر بسبب انبعاث أيونات الباريوم.
- مبيد القوارض – يستخدم كمبيد للقوارض لقتل الجرذان والفئران، لأنه سام بالنسبة لها.
- المؤكسد – يستخدم في الصواعق والمتفجرات، وهو عامل مؤكسد قوي يمكن أن يعزز احتراق المواد الأخرى.
- التمهيدي – يستخدم في البادئات والرصاصات التتبعية لأنه يوفر اشتعالًا ورؤية الذخيرة.
- الصباغ – يستخدم في صناعة الدهانات والأصباغ لأنه يمكن أن يمنحها اللون الأبيض أو الأخضر.
- عامل مؤكسد – يستخدم كعامل مؤكسد في التفاعلات الكيميائية المختلفة، مثل تخليق بيروكسيد الباريوم وهيدروكسيد الباريوم.
- المتفجرات – تستخدم في صناعة المتفجرات مثل باراتول، وهو خليط من Ba(NO3)2، TNT ومادة رابطة.
أسئلة:
س: هل نترات الباريوم قابلة للذوبان؟
ج: Ba(NO3)2 قابل للذوبان في الماء وبعض المذيبات الأخرى، مثل الإيثانول والأسيتون والميثانول.
س: هل نترات الباريوم مفيدة للخرسانة؟
ج: Ba(NO3)2 ليس مفيداً للخرسانة، لأنه يمكن أن يسبب تآكل حديد التسليح وتشقق الخرسانة.
س: هل يتشكل راسب عند اتحاد محاليل كبريتات البوتاسيوم ونترات الباريوم؟
ج: نعم، يتكون راسب كبريتات الباريوم (BaSO4) إذا تم دمج محاليل كبريتات البوتاسيوم (K2SO4) ونترات الباريوم (Ba(NO3)2).
س: نترات الباريوم لها الصيغة Ba(NO3)2. ما العبارة الصحيحة بشأن نترات الباريوم؟
ج: إحدى العبارات المحتملة هي: Ba(NO3)2 مركب أيوني يتكون من أيون باريوم واحد وأيونات نترات.
س: هل نترات الباريوم متطايرة؟
ج: لا، Ba(NO3)2 ليس مادة متطايرة، حيث أن درجة انصهاره عالية ويتحلل قبل الغليان.
س: هل نترات الباريوم محايدة؟
ج: لا، Ba(NO3)2 ليس متعادلًا، لأنه ملح حمضي يمكن أن يخفض الرقم الهيدروجيني للمحلول.
س: ما الذي ينتج من تفاعل استبدال Ba(NO3)2 وNa2SO4؟
ج: يتم إنتاج NaNO3 وBaSO4 أثناء تفاعل استبدال Ba(NO3)2 وNa2SO4.
س: هل Ba(NO3)2 قابل للذوبان في الماء؟
ج: نعم، Ba(NO3)2 قابل للذوبان في الماء، لأنه يذوب لتكوين أيونات الباريوم وأيونات النترات.
س: ما هي المعادلة الأيونية الصافية لتفاعل MgSO4 مع Ba(NO3)2؟
ج: المعادلة الأيونية الصافية لتفاعل MgSO4 مع Ba(NO3)2 هي:
Ba2+ + SO42- → BaSO4
س: ما عدد المولات الموجودة في 432 جم من Ba(NO3)2؟
ج: عدد المولات في 432 جم من Ba(NO3)2 هو:
ن = م/م، ن = 432/261337، ن = 1653 مول
س: هل Ba(NO3)2 قابل للذوبان؟
ج: نعم، Ba(NO3)2 قابل للذوبان، لأنه يذوب لتكوين أيونات الباريوم وأيونات النترات.
