كلوريد النيكل (II)، المعروف باسم NiCl2، هو مركب كيميائي أصفر مخضر. يستخدم بشكل شائع في الطلاء الكهربائي والمحفزات وكمقدمة في تخليق مركبات النيكل الأخرى.
| اسم الأيوباك | كلوريد النيكل (II). |
| الصيغة الجزيئية | NiCl2 |
| CAS رقم | 7718-54-9 |
| المرادفات | كلوريد النيكل، ثنائي كلوريد النيكل، ثنائي كلورونيكل، كلوريد النيكل |
| إنتشي | InChI=1S/2ClH.Ni/h2*1H;/q;;+2/p-2 |
خصائص كلوريد النيكل
صيغة كلوريد النيكل
صيغة ثنائي كلوريد النيكل هي NiCl2. يشير هذا إلى أن كل جزيء ثنائي كلوريد النيكل يتكون من ذرة نيكل واحدة مرتبطة بذرتين من ذرات الكلور. توفر هذه الصيغة الكيميائية معلومات مهمة حول تكوين ونسبة العناصر الموجودة في المركب.
كلوريد النيكل الكتلة المولية
تبلغ الكتلة المولية لثنائي كلوريد النيكل، المحسوبة عن طريق إضافة الكتل الذرية للعناصر المكونة له، حوالي 129.6 جرامًا لكل مول. هذه القيمة مفيدة لتحديد كمية ثاني كلوريد النيكل الموجودة في عينة معينة ولإجراء حسابات متكافئة مختلفة.
نقطة غليان كلوريد النيكل
تبلغ درجة غليان ثنائي كلوريد النيكل حوالي 1.007 درجة مئوية (1.845 درجة فهرنهايت). عند درجة الحرارة هذه، يمر المركب بمرحلة انتقالية من حالته السائلة إلى الحالة الغازية. تعتبر نقطة الغليان خاصية فيزيائية مهمة تساعد على فهم سلوك ثاني كلوريد النيكل عند تسخينه.
نقطة انصهار كلوريد النيكل
تبلغ نقطة انصهار ثاني كلوريد النيكل حوالي 1002 درجة مئوية (1836 درجة فهرنهايت). هذه هي درجة الحرارة التي يتغير عندها الشكل الصلب لثاني كلوريد النيكل إلى الحالة السائلة. تعد نقطة الانصهار مهمة للتطبيقات التي تتضمن معالجة ومعالجة ثاني كلوريد النيكل.
كثافة كلوريد النيكل جم/مل
تبلغ كثافة ثاني كلوريد النيكل حوالي 3.55 جرام لكل مليلتر. الكثافة هي مقياس للكتلة لكل وحدة حجم من المادة وتوفر معلومات حول ضغط المادة. تساعد كثافة ثاني كلوريد النيكل في تحديد سلوكه في التطبيقات المختلفة وفي الحالات الفيزيائية المختلفة.
الوزن الجزيئي لكلوريد النيكل
يبلغ الوزن الجزيئي لثاني كلوريد النيكل حوالي 129.6 جرامًا لكل مول. ويتم حسابه عن طريق إضافة الكتل الذرية للنيكل والكلور في المركب. الوزن الجزيئي ضروري لفهم العلاقات بين الكتلة والشامات وعدد الجزيئات في التفاعلات الكيميائية.
هيكل كلوريد النيكل
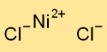
يستخدم ثنائي كلوريد النيكل بنية شبكية بلورية في شكله الصلب. وهو يتألف من كاتيونات النيكل (Ni2+) وأنيونات الكلوريد (Cl-) مرتبة بالتناوب. يشكل هذا الترتيب شبكة ثلاثية الأبعاد تساهم في الاستقرار والخصائص الفيزيائية لثاني كلوريد النيكل.
ذوبان كلوريد النيكل
يتمتع ثنائي كلوريد النيكل بقابلية ذوبان معتدلة في الماء. قد يذوب ليشكل محلول أصفر مخضر. تتأثر قابلية ذوبان ثاني كلوريد النيكل بعوامل مثل درجة الحرارة ووجود مواد أخرى. إن فهم قابليته للذوبان أمر مهم في العمليات الصناعية المختلفة والتطبيقات الكيميائية التي تشمل ثاني كلوريد النيكل.
| مظهر | صلبة صفراء مخضرة |
| جاذبية معينة | 3.55 جرام/مل |
| لون | اصفر مائل للخضرة |
| يشم | عديم الرائحة |
| الكتلة المولية | 129.6 جرام/مول |
| كثافة | 3.55 جرام/مل |
| نقطة الانصهار | 1002 درجة مئوية (1836 درجة فهرنهايت) |
| نقطة الغليان | 1007 درجة مئوية (1845 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | معتدل |
| الذوبان | قابل للذوبان في المذيبات العضوية (الإيثانول والأسيتون) والأحماض |
| ضغط البخار | غير متاح |
| كثافة بخار | غير متاح |
| pKa | غير متاح |
| الرقم الهيدروجيني | حمض (حوالي 4) |
سلامة كلوريد النيكل ومخاطره
يشكل ثنائي كلوريد النيكل بعض مخاطر السلامة التي يجب أخذها في الاعتبار. من المهم التعامل مع هذا المركب بعناية لتجنب المخاطر المحتملة. يمكن أن يسبب ثنائي كلوريد النيكل تهيج الجلد وحساسيته، لذا يجب ارتداء القفازات والملابس الواقية عند التعامل معه. يجب تجنب استنشاق غبار أو بخار ثنائي كلوريد النيكل لأن ذلك قد يسبب تهيج الجهاز التنفسي. يمكن أن يكون تناول ثنائي كلوريد النيكل ضارًا ويجب تجنبه. بالإضافة إلى ذلك، يعتبر ثنائي كلوريد النيكل سامًا للحياة المائية ويمكن أن يسبب أضرارًا بيئية إذا تم إطلاقه في المسطحات المائية. وينبغي اتباع إجراءات التخزين والتعامل والتخلص المناسبة لتقليل المخاطر المرتبطة بثاني كلوريد النيكل.
| رموز الخطر | تآكل، ضارة، المخاطر البيئية |
| وصف الأمان | – ارتداء القفازات والملابس الواقية – تجنب استنشاق الغبار أو البخار – منع الابتلاع – تخزينها والتعامل معها والتخلص منها بشكل صحيح |
| معرفات الأمم المتحدة | UN3288 |
| رمز النظام المنسق | 2827.39.80 |
| فئة الخطر | 8 (تآكل) |
| مجموعة التعبئة | ثالثا |
| تسمم | ضار إذا ابتلع، يسبب تهيج الجلد والعين |
طرق تصنيع كلوريد النيكل
هناك عدة طرق لتصنيع ثنائي كلوريد النيكل، ولكل منها مزاياها وتطبيقاتها.
تتضمن الطريقة الشائعة تفاعل النيكل المعدني أو أكسيد النيكل مع حمض الهيدروكلوريك. في هذه العملية، يضاف النيكل المعدني أو أكسيد النيكل إلى حاوية مناسبة ويقلب مع إضافة حمض الهيدروكلوريك ببطء. التفاعل بين النيكل والحمض ينتج ثنائي كلوريد النيكل بالإضافة إلى إطلاق غاز الهيدروجين.
تتضمن طريقة التوليف الأخرى التفاعل بين كربونات النيكل وحمض الهيدروكلوريك. يذيب حمض الهيدروكلوريك كربونات النيكل ويخضع المحلول الساخن للتفاعل لتكوين ثنائي كلوريد النيكل وإطلاق غاز ثاني أكسيد الكربون.
يخضع حمض الهيدروكلوريك للتفاعل مع هيدروكسيد النيكل المذاب عندما يتم تسخين المحلول أو تركه في مكانه، مما يؤدي إلى تخليق ثنائي كلوريد النيكل. يؤدي التفاعل إلى تكوين ثنائي كلوريد النيكل والماء.
بالإضافة إلى ذلك، يمكن تحضير ثنائي كلوريد النيكل عن طريق تفاعل النيكل المعدني مع غاز الكلور. وهذا التفاعل المباشر بين العنصرين يعطي ثنائي كلوريد النيكل.
توفر طرق التوليف هذه طرقًا مختلفة للحصول على ثنائي كلوريد النيكل، مما يسمح بالمرونة فيما يتعلق بالمواد الخام وظروف التفاعل. يعتمد اختيار الطريقة على عوامل مثل النقاء المطلوب للمنتج النهائي، وتوافر المواد الخام ومتطلبات التطبيق المحددة.
استخدامات كلوريد النيكل
لثنائي كلوريد النيكل تطبيقات مختلفة في صناعات مختلفة نظرًا لخصائصه الفريدة. فيما يلي بعض استخداماته البارزة:
- الطلاء الكهربائي: تستخدم عمليات الطلاء الكهربائي عادةً ثنائي كلوريد النيكل لتوفير طبقة واقية وزخرفية على الأسطح المختلفة. يعمل ثنائي كلوريد النيكل على تحسين مظهر المعادن مثل الفولاذ والنحاس والنحاس مع توفير مقاومة للتآكل.
- المحفز: يعمل ثنائي كلوريد النيكل كمحفز في العديد من التفاعلات الكيميائية، بما في ذلك عمليات الهدرجة والبلمرة. فهو يسهل تحويل المواد المتفاعلة إلى المنتجات المطلوبة ويجد التطبيق في إنتاج الأدوية والبلاستيك والألياف الاصطناعية.
- التخليق الكيميائي: يعمل ثنائي كلوريد النيكل كمقدمة في تخليق مركبات النيكل المختلفة، مثل أكسيد النيكل وكبريتيد النيكل وسيانيد النيكل. وتستخدم الصناعات هذه المركبات في المواد الحفازة والأصباغ والسيراميك والمواد المغناطيسية.
- البطاريات: تستخدم البطاريات القابلة لإعادة الشحن، وخاصة بطاريات هيدريد معدن النيكل (NiMH)، ثنائي كلوريد النيكل كإلكتروليت. فهو يسمح بتداول الأيونات بين الأقطاب الكهربائية أثناء دورات الشحن والتفريغ.
- تنقية الغاز: تستخدم الصناعات ثاني كلوريد النيكل في عمليات تنقية الغاز لإزالة الشوائب مثل كبريتيد الهيدروجين وأول أكسيد الكربون. يجد تطبيقات في تكرير الغاز الطبيعي ومعالجة البتروكيماويات.
- مكملات الأعلاف الحيوانية: تحتوي علف الماشية، وخاصة أعلاف الدواجن والخنازير، على ثنائي كلوريد النيكل كمكمل غذائي. إنه يسهل نشاط الإنزيم ويساهم في الصحة العامة ونمو الحيوانات.
- الأبحاث المعملية: يستخدم الباحثون ثنائي كلوريد النيكل في مجموعة متنوعة من التجارب المعملية، بما في ذلك التفاعلات المحفزة بالنيكل وكمصدر لأيونات النيكل للتحليل الكيميائي.
توضح هذه التطبيقات المتنوعة تنوع وأهمية ثاني كلوريد النيكل في قطاعات تتراوح من التصنيع والطاقة إلى الزراعة والبحث.
أسئلة:
س: ما الأيونات الموجودة في المحلول المائي لـ NiCl2؟
ج: في المحلول المائي لـ NiCl2، الأيونات الموجودة هي Ni2+ (كاتيون النيكل) وCl- (أنيون الكلوريد).
س: هل NiCl2 قابل للذوبان في الماء؟
ج: نعم، NiCl2 قابل للذوبان في الماء ويشكل محلول مائي أصفر مخضر.
س: ما هو المعدن الذي يتفاعل تلقائيا مع NiCl2(aq)؟
ج: تتفاعل المعادن مثل المغنيسيوم (Mg) والزنك (Zn) تلقائيًا مع NiCl2(aq) لإزاحة النيكل وتكوين الكلوريدات الخاصة بهما.
س: هل NiCl2 قطبي أم غير قطبي؟
ج: NiCl2 مركب قطبي بسبب اختلاف السالبية الكهربية بين النيكل والكلور، مما يؤدي إلى عدم تكافؤ توزيع الشحنات.
س: هل NiCl2 مائي؟
ج: نعم، يمكن أن يتواجد NiCl2 في حالة مائية عندما يذوب في الماء، مكونًا محلولًا مائيًا.
س: ما اسم المركب الذي صيغته NiCl2 ؟
ج: المركب الذي له الصيغة NiCl2 يسمى كلوريد النيكل الثنائي.
س: كيف يمكنك تحضير 1.00 L من محلول 0.50 M NiCl2؟
ج: لتحضير محلول 0.50 M من NiCl2، قم بإذابة 129.6 جرام من NiCl2 في الماء وجعل الحجم 1.00 لتر.
س: ما هو الملح غير القابل للذوبان الذي يتكون بين محلول Na2S و NiCl2؟
ج: عند خلط محلول Na2S مع NiCl2 يتكون كبريتيد النيكل غير القابل للذوبان (NiS).
س: هل NiCl2(aq) مادة صلبة؟
ج: لا، يشير NiCl2(aq) إلى محلول مائي من NiCl2، مما يدل على أنه في صورة سائلة.
س: ما الذي يجعل كلوريد النيكل (II) البلوري أخضر؟
ج: يرجع اللون الأخضر لكلوريد النيكل (II) البلوري إلى وجود كاتيونات النيكل (Ni2+) في الشبكة البلورية.
س: هل ثنائي كلوريد النيكل سام؟
ج: نعم، ثنائي كلوريد النيكل سام ويجب التعامل معه بحذر. يمكن أن يسبب تهيج الجلد ومشاكل في الجهاز التنفسي ويكون ضارًا إذا تم ابتلاعه.
س: هل يحدث تفاعل عند اتحاد المحاليل المائية لـ NiCl2 وNa2S؟
ج: نعم، يحدث التفاعل عندما يتم دمج المحاليل المائية لـ NiCl2 وNa2S، مما يؤدي إلى تكوين كبريتيد النيكل غير القابل للذوبان (NiS) وكلوريد الصوديوم القابل للذوبان (NaCl).
س: ما عدد جرامات NiCl2 اللازمة لتحييد 75.0 مل من 0.555 م من هيدروكسيد الليثيوم؟
ج: يلزم وجود 18.4 جرام تقريبًا من NiCl2 لتحييد 75.0 مل من 0.555 مولار من هيدروكسيد الليثيوم في تفاعل متكافئ.
س: ماذا يحدث عند خلط كربونات الأمونيوم وثاني كلوريد النيكل والماء؟
ج: عند خلط كربونات الأمونيوم وثاني كلوريد النيكل والماء، يحدث تفاعل يؤدي إلى تكوين كلوريد الأمونيوم وكربونات النيكل والماء.
