كلوريد الكالسيوم مركب غير عضوي شديد الذوبان له الصيغة CaCl2. يستخدم بشكل شائع كعامل تذويب ومجفف وفي إنتاج أملاح الكالسيوم والمواد الكيميائية.
| اسم الأيوباك | كلوريد الكالسيوم |
| الصيغة الجزيئية | CaCl2 |
| CAS رقم | 10043-52-4 |
| المرادفات | ثنائي كلوريد الكالسيوم، كلوريد الكالسيوم (II). |
| E509، ملح التخليل، دوفليك، بيلادو، تترا | |
| إنتشي | InChI=1S/Ca.2ClH/h;2*1H/q+2;;/p-2 |
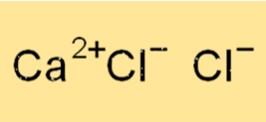
صيغة كلوريد الكالسيوم
الصيغة الكيميائية لكلوريد الكالسيوم هي CaCl2. وهذا يعني أن كل وحدة من كلوريد الكالسيوم تتكون من أيون كالسيوم واحد (Ca2+) وأيوني كلوريد (Cl-). كلوريد الكالسيوم مركب أيوني، مما يعني أنه يرتبط ببعضه البعض عن طريق التجاذب الكهروستاتيكي بين أيون الكالسيوم الموجب الشحنة وأيونات الكلوريد المشحونة سالبًا.
الكتلة المولية لكلوريد الكالسيوم
يحتوي كلوريد الكالسيوم على كتلة مولية تبلغ 110.98 جم/مول، وهو ما يتوافق مع مجموع الكتل الذرية لذرة واحدة من ذرة Ca وذرتين من ذرات Cl. وهو مركب غير عضوي شديد الذوبان في الماء. الماء ويستخدم بشكل شائع كعامل تجفيف ومجفف وعامل إزالة الجليد. ويستخدم كلوريد الكالسيوم أيضًا في إنتاج أملاح الكالسيوم والمواد الكيميائية الأخرى.
نقطة غليان CaCl2
درجة غليان CaCl2 هي 1935 درجة مئوية، وهي درجة عالية جدًا بالنسبة للمركب غير العضوي. ويرجع ذلك إلى الروابط الأيونية القوية بين أيونات Ca+2 وCl-، والتي تتطلب الكثير من الطاقة لكسرها. CaCl2 هو مركب استرطابي، مما يعني أنه يمتص الرطوبة من الهواء ويمكن أن يذوب في الماء ليشكل محلول عالي التركيز.
نقطة انصهار CaCl2
درجة انصهار CaCl2 هي 772 درجة مئوية. له بنية بلورية وعادة ما يوجد في شكله اللامائي، مما يعني أنه لا يحتوي على جزيئات الماء. عندما يتم تسخين CaCl2، فإنه يتحلل إلى أكسيد الكالسيوم وغاز كلوريد الهيدروجين.
كثافة CaCl2 جم/مل
تعتمد كثافة CaCl2 على تركيز المحلول. تبلغ كثافة محلول 1 M من CaCl 2 حوالي 1.4 جم / مل، بينما تبلغ كثافة محلول 3 M حوالي 1.6 جم / مل. تبلغ كثافة CaCl2 الصلب 2.15 جم/سم3.
الوزن الجزيئي لـ CaCl2
الوزن الجزيئي لـ CaCl2 هو 110.98 جم/مول. وهو مركب غير عضوي يتكون من ذرة Ca واحدة وذرتين Cl. CaCl2 عبارة عن مادة صلبة بلورية بيضاء في درجة حرارة الغرفة وقابلة للذوبان بدرجة عالية في الماء.
هيكل CaCl2
يحتوي CaCl2 على بنية شبكية بلورية، والتي ترتبط معًا بواسطة روابط أيونية بين كاتيون الكالسيوم (Ca2+) وأنيون الكلوريد (Cl-). كل أيون Ca+2 محاط بستة أيونات Cl- وكل أيون كلوريد محاط بستة أيونات كالسيوم. التركيب البلوري لـ CaCl هو مكعب، حيث تحتوي كل خلية وحدة على أيون كالسيوم واحد وأيونات كلوريد.
| مظهر | الصلبة البيضاء |
| جاذبية معينة | 2.15 (صلب)، 1.4-1.6 (محلول) |
| لون | عديم اللون |
| يشم | عديم الرائحة |
| الكتلة المولية | 110.98 جرام/مول |
| كثافة | 2.15 جم/سم3 (صلب)، 1.4-1.6 جم/سم3 (محلول) |
| نقطة الانصهار | 772 درجة مئوية |
| نقطة الغليان | 1935 درجة مئوية |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان جدا في الماء |
| الذوبان | قابل للذوبان في الإيثانول والأسيتون |
| ضغط البخار | ضئيلة |
| كثافة بخار | غير قابل للتطبيق |
| pKa | – |
| الرقم الهيدروجيني | 4.5-11.0 (محلول 10%) |
سلامة ومخاطر كلوريد الكالسيوم
قد يسبب CaCl2 تهيجًا للجلد والعين، كما أن استنشاق غباره أو رذاذه قد يسبب تهيج الجهاز التنفسي. يمكن أن يسبب أيضًا حروقًا إذا لامس الجلد أو العينين. يعتبر CaCl2 مادة استرطابية، مما يعني أنه يمكن أن يمتص الرطوبة ويطلق الحرارة، مما قد يتسبب في تمزق الحاويات أو انفجارها. كما أنه يسبب تآكلًا لبعض المعادن ويمكن أن يتفاعل مع بعض المواد العضوية. وينبغي استخدام معدات الحماية المناسبة، مثل القفازات والنظارات الواقية، عند التعامل مع CaCl2. يجب تنظيف الانسكابات على الفور وتخزين الحاويات في منطقة باردة وجافة وجيدة التهوية.
| رموز الخطر | تآكل، مهيج |
| وصف الأمان | ارتداء القفازات الواقية وحماية العين/الوجه. لا تتنفس الغبار/الأبخرة/الغاز/الضباب/الأبخرة. |
| أرقام تعريف الأمم المتحدة | رقم الأمم المتحدة 3077، رقم الأمم المتحدة 1786 (أونصة رطبة) |
| رمز النظام المنسق | 2827.39.90 |
| فئة الخطر | 8 (المواد المسببة للتآكل) |
| مجموعة التعبئة | ثالثا |
| تسمم | السمية منخفضة بالنسبة لمعظم التطبيقات، ولكن يمكن أن تكون خطيرة عند تناولها بكميات كبيرة |
طرق تصنيع كلوريد الكالسيوم
لتجميع CaCl2، تتوفر عدة طرق.
تتضمن إحدى الطرق تفاعل كربونات الكالسيوم أو هيدروكسيد الكالسيوم مع حمض الهيدروكلوريك . إحدى الطرق هي إضافة كربونات الكالسيوم أو هيدروكسيد الكالسيوم إلى حمض الهيدروكلوريك . يتبخر المحلول ليعطي CaCl2.
هناك طريقة أخرى وهي تفاعل أكسيد الكالسيوم مع حمض الهيدروكلوريك . تتضمن هذه الطريقة إضافة أكسيد الكالسيوم إلى حمض الهيدروكلوريك ثم تبخير المحلول للحصول على CaCl2.
الطريقة الثالثة تتضمن تفاعل الكالسيوم المعدني مع غاز الكلور . الطريقة الأقل شيوعًا هي تسخين معدن الكالسيوم في وجود غاز الكلور. ينتج عن التفاعل CaCl2، لكن الخبراء لا يستخدمون هذا الأسلوب بشكل متكرر بسبب التفاعل العالي لمعدن الكالسيوم والحاجة إلى معالجة متخصصة.
لإنتاج CaCl2 باستخدام طريقة مختلفة، يمكن استخدام المنتج الثانوي لعملية سولفاي، التي تولد كلوريد الصوديوم وCaCl2. تتضمن العملية استخلاص CaCl2 من المنتج الثانوي من خلال تقنيات الترشيح والتبخر والتنقية. تساعد هذه الخطوات على إزالة جميع الشوائب وإنتاج CaCl2 عالي النقاء.
استخدامات كلوريد الكالسيوم
يحتوي CaCl2 على العديد من التطبيقات الصناعية:
- يستخدم كمجفف لامتصاص الرطوبة، وعامل إزالة الجليد للطرق والأرصفة، ومخثر في إنتاج التوفو وغيرها من الأطعمة.
- يستخدم في صناعة النفط والغاز لزيادة كثافة سوائل الحفر وتقليل درجة تجمد الماء في خطوط الأنابيب.
- يستخدم في الخلطات الخرسانية لتسريع عملية المعالجة وزيادة قوة ومتانة المنتج النهائي.
- يستخدم في إنتاج الورق لزيادة قوة وثبات ألياف الورق.
- يستخدم في معالجة المياه لإزالة الشوائب وتليين المياه.
- يستخدم كمصدر لأيونات الكالسيوم في التطبيقات الطبية، مثل السوائل الوريدية ولعلاج نقص كلس الدم.
- يستخدم في إنتاج البلاستيك والمطاط لزيادة صلابة ومتانة المنتج النهائي.
- يستخدم في حفظ الفواكه والخضروات لمنع تلفها وللمحافظة على قوام ونكهة المنتج.
- يستخدم في إنتاج المنسوجات لتحسين امتصاص الصبغة وزيادة قوة الألياف ومرونتها.
- يستخدم أيضًا في إنتاج طفايات الحريق وكأحد مكونات المواد المثبطة للهب لمنع انتشار اللهب.
أسئلة:
س: ما هو كلوريد الكالسيوم؟
ج: كلوريد الكالسيوم مركب كيميائي يتكون من أيونات Ca2+ و Cl- وصيغته الكيميائية CaCl2.
س: هل كلوريد الكالسيوم أيوني أم تساهمي؟
ج: CaCl2 مركب أيوني لأنه يتكون من أيونات Ca2+ موجبة الشحنة وأيونات Cl- سالبة الشحنة، ترتبط ببعضها بواسطة روابط أيونية.
س: ما هو كلوريد الكالسيوم المستخدم؟
ج: CaCl2 له العديد من الاستخدامات الصناعية والتجارية والطبية، بما في ذلك كمادة مجففة، وعامل إزالة الجليد، ومخثر في إنتاج الغذاء، ومسرع في الخرسانة، ومنقي المياه ومصدر لأيونات الكالسيوم في العلاجات الطبية.
س: ما هي صيغة كلوريد الكالسيوم؟
ج: صيغة كلوريد الكالسيوم هي CaCl2، مما يشير إلى أن كل جزيء يحتوي على أيون كالسيوم واحد وأيونات كلوريد.
س: هل CaCl2 أيوني أم تساهمي؟
ج: CaCl2 مركب أيوني لأنه يتكون من أيونات كالسيوم موجبة الشحنة وأيونات كلوريد سالبة الشحنة، وترتبط ببعضها البعض بواسطة روابط أيونية.
س: هل CaCl2 قابل للذوبان في الماء؟
ج: نعم، CaCl2 قابل للذوبان بدرجة عالية في الماء، مما يعني أنه يمكن أن يذوب بسهولة في الماء لتكوين محلول واضح.
س: إذا تم إذابة CaCl2 في الماء، ماذا يمكن أن نقول عن تركيز أيون Ca2+؟
ج: عندما يذوب CaCl2 في الماء، فإنه يتفكك إلى الأيونات المكونة له، Ca2+ و2Cl-. بما أن CaCl2 يتفكك تمامًا في الماء، فإن تركيز أيونات Ca2+ في المحلول يكون ضعف تركيز CaCl2.
