كلوريد الستانوس هو مركب كيميائي له الصيغة SnCl2. يتم استخدامه كعامل اختزال، ولاذع في صباغة المنسوجات وكاختبار للذهب.
| اسم الأيوباك | كلوريد القصدير (II). |
| الصيغة الجزيئية | سنكل2 |
| CAS رقم | 7772-99-8 |
| المرادفات | ثنائي كلوريد القصدير، كلوريد القصدير (II)، ملح القصدير، بروتوكلوريد القصدير، ثنائي هيدرات ثنائي كلوريد القصدير |
| إنتشي | InChI=1S/2ClH.Sn/h2*1H;/q;;+2/p-2 |
الكتلة المولية من كلوريد الستانوس
يحتوي SnCl2 على كتلة مولية تبلغ 189.6 جم/مول. وهو مركب يتكون من ذرة قصدير واحدة وذرتين كلور. يتم حساب الكتلة المولية عن طريق جمع الكتل الذرية لكل عنصر في المركب، وهي 118.71 جم/مول للقصدير و35.45 جم/مول للكلور. SnCl2 عبارة عن مادة صلبة بلورية بيضاء في درجة حرارة الغرفة وقابلة للذوبان في الماء والكحول.
نقطة غليان كلوريد الستانوس
نقطة غليان SnCl2 هي 623 درجة مئوية (1153 درجة فهرنهايت). هذه هي درجة الحرارة التي يتحول عندها الشكل السائل لـ SnCl2 إلى غاز. تعتبر نقطة الغليان خاصية فيزيائية مهمة للمادة لأنها تحدد الظروف التي سوف تتبخر فيها. يستخدم SnCl2 بشكل شائع كعامل اختزال في التفاعلات الكيميائية ونقطة غليانه العالية تجعله مفيدًا في تطبيقات درجات الحرارة المرتفعة.
نقطة انصهار كلوريد الستانوس
نقطة انصهار SnCl2 هي 246 درجة مئوية (475 درجة فهرنهايت). هذه هي درجة الحرارة التي يتحول عندها الشكل الصلب لـ SnCl2 إلى سائل. تعد نقطة الانصهار خاصية فيزيائية مهمة للمادة لأنها تحدد الظروف التي ستتحول فيها من مادة صلبة إلى سائلة. يُستخدم SnCl2 في مجموعة متنوعة من التطبيقات الصناعية والمختبرية، بما في ذلك كعامل اختزال، كمادة لاذعة في صباغة المنسوجات، وكاختبار للذهب.
كثافة كلوريد الستانوس جم/مل
تبلغ كثافة SnCl2 3.95 جم/مل. الكثافة هي خاصية فيزيائية للمادة تصف كتلة المادة لكل وحدة حجم. ترجع الكثافة العالية لـ SnCl2 إلى ذرات القصدير الثقيلة نسبيًا. كثافة SnCl2 تجعله مفيدًا في التطبيقات التي تتطلب سوائل عالية الكثافة، مثل التركيب والتحليل الكيميائي.
الوزن الجزيئي للكلوريد الستانوس
الوزن الجزيئي لـ SnCl2 هو 189.6 جم/مول. الوزن الجزيئي هو مجموع الأوزان الذرية لجميع الذرات الموجودة في الجزيء. يعد الوزن الجزيئي لـ SnCl2 مهمًا في تحديد كمية المادة المطلوبة لتفاعل أو عملية معينة.
هيكل كلوريد الستانوس
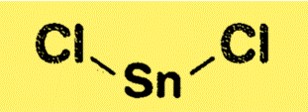
يحتوي SnCl2 على بنية بلورية تكون فيها كل ذرة قصدير محاطة بأربع ذرات كلور مرتبة في شكل رباعي الأسطح. يشبه هذا الهيكل هيكل هاليدات المعادن الأخرى، مثل كلوريد الألومنيوم وكلوريد الحديد (III). يُعرف SnCl2 أيضًا باسم كلوريد القصدير (II) لأنه يحتوي على القصدير في حالة الأكسدة +2.
صيغة كلوريد الستانوس
صيغة كلوريد الستانوس هي SnCl2. تشير هذه الصيغة إلى أن كل جزيء كلوريد القصدير يحتوي على ذرة قصدير واحدة وذرتين كلور. الصيغة مهمة في التفاعلات الكيميائية لأنها تسمح للعلماء بالتنبؤ بالمنتجات التي سيتم تشكيلها عندما يتفاعل كلوريد القصدير مع مواد أخرى. الصيغة مهمة أيضًا في التطبيقات الصناعية والمختبرية، حيث يجب إضافة كميات دقيقة من كلوريد الستانوس لتحقيق النتائج المرجوة.
| مظهر | مادة صلبة بلورية بيضاء |
| جاذبية معينة | 3.95 |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 189.6 جرام/مول |
| كثافة | 3.95 جم/مل |
| نقطة الانصهار | 246 درجة مئوية (475 درجة فهرنهايت) |
| نقطة الغليان | 623 درجة مئوية (1153 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان |
| الذوبان | قابل للذوبان في الماء والإيثانول والأسيتون |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | 2.7 |
| الرقم الهيدروجيني | 2.5 – 3.0 |
السلامة ومخاطر كلوريد الستانوس
يمكن أن يكون SnCl2 (SnCl2) خطيرًا إذا لم يتم التعامل معه بشكل صحيح. وهو يسبب تآكل الجلد والعينين ويمكن أن يسبب حروقًا شديدة. وقد يسبب أيضًا تهيجًا في الجهاز التنفسي في حالة استنشاقه. عند التعامل مع SnCl2، يجب عليك استخدام معدات الحماية الشخصية المناسبة، مثل القفازات والنظارات الواقية، في منطقة جيدة التهوية. يجب عليك تخزينه في حاوية مغلقة بإحكام، بعيداً عن الحرارة ومصادر الاشتعال والمواد غير المتوافقة. إذا لامس بشرتك، يجب عليك غسل المنطقة المصابة جيدًا بالماء والصابون. إذا دخل في عينيك، اغسل العين المصابة بالماء على الفور لمدة 15 دقيقة على الأقل واطلب الرعاية الطبية.
| رموز الخطر | تآكل |
| وصف الأمان | يحفظ بعيدا عن متناول الأطفال. لا تتنفس الغبار / الأبخرة / الغاز / الضباب / الأبخرة / الرذاذ. ارتداء القفازات الواقية / الملابس الواقية / حماية العين / حماية الوجه. في حالة الاستنشاق: أخرج الضحية إلى الهواء النقي وابقها في وضع مريح للتنفس. إذا كان في العينين: اشطفيه بحذر بالماء لعدة دقائق. إزالة العدسات اللاصقة، إذا كانت موجودة وسهلة للقيام. استمر في الشطف. |
| معرفات | UN2802 |
| رمز النظام المنسق | 2827.39 |
| فئة الخطر | 8 |
| مجموعة التعبئة | ثالثا |
| تسمم | سامة إذا ابتلع أو استنشاقه. تآكل الجلد والعينين |
طرق لتخليق كلوريد الستانوس
هناك عدة طرق لتجميع كلوريد الستانوس، بما في ذلك:
تؤدي إضافة القصدير إلى حمض الهيدروكلوريك إلى تكوين كلوريد القصدير وغاز الهيدروجين:
معادلة التفاعل هي Sn + 2HCl → SnCl2 + H2
إضافة القصدير إلى محلول مائي من الكلور، مما يؤدي إلى تكوين كلوريد الستانوس وحمض الهيدروكلوريك:
معادلة التفاعل هي Sn + Cl2 + 2H2O → SnCl2 + 2HCl
اختزال كلوريد القصدير (IV) بغاز الهيدروجين أو الزنك، مما يؤدي إلى تكوين كلوريد القصدير:
معادلات التفاعل هي SnCl4 + 2H2 → SnCl2 + 4HCl وSnCl4 + Zn → SnCl2 + ZnCl2، على التوالي.
إعادة البلورة من الماء أو الإيثانول يمكن أن تحسن من نقاء كلوريد القصدير المنتج. هناك طريقة أخرى شائعة الاستخدام للإنتاج على نطاق صناعي وهي التحليل الكهربائي لمحلول كلوريد القصدير (II) في حمض الهيدروكلوريك.
من المهم التعامل مع المواد الخطرة والتخلص منها بعناية عند تصنيع كلوريد الستانوس، وينبغي اتخاذ احتياطات السلامة المناسبة في جميع الأوقات.
استخدامات كلوريد الستانوس
يلعب كلوريد الستانوس (SnCl2) دورًا حاسمًا في مختلف الصناعات نظرًا لتطبيقاته المتعددة. يستخدمه الكيميائيون كعامل اختزال في التخليق الكيميائي وكمصدر لأيونات القصدير في طلاء القصدير وطلاءات أكسيد القصدير. بالإضافة إلى ذلك، يستخدم خبراء صباغة المنسوجات SnCl2 كمادة لاذعة.
تعتمد صناعات مثل الأواني الزجاجية والسيراميك والأصباغ على SnCl2 أثناء عمليات الإنتاج. يتم أيضًا تصنيع أملاح القصدير ومركبات القصدير الأخرى باستخدام هذا المركب.
في الصناعة الطبية، يعمل SnCl2 كأداة تشخيصية في تصوير الطب النووي. بالإضافة إلى ذلك، يستخدمه أطباء الأسنان في سبائك الأسنان، وفي علاج التهاب اللثة، وكمطهر لمعدات طب الأسنان.
يتم استخدام SnCl2 في صناعة المواد الغذائية كمادة حافظة ومضادة للأكسدة ومثبت لون للفواكه والخضروات المعلبة. بالإضافة إلى ذلك، فهو يعمل كمثبت للون في البيرة وكعامل ترك في مسحوق الخبز.
يستخدم فنيو الألعاب النارية SnCl2 لإنتاج الألعاب النارية، ويستخدمه الكيميائيون العضويون كمحفز في تفاعلات مختلفة. بالإضافة إلى ذلك، تم بحثه كعلاج محتمل للسرطان وأمراض أخرى.
في الختام، يعد SnCl2 مركبًا أساسيًا في العديد من الصناعات ويساهم تعدد استخداماته في تطبيقاته الآخذة في التوسع.
أسئلة:
س: ما هو دور كلوريد القصدير في معجون الأسنان؟
ج: غالبًا ما يستخدم SnCl2 في معجون الأسنان كعامل مضاد للبكتيريا وللمساعدة في تقليل حساسية الأسنان. وقد ثبت أنه يساعد في السيطرة على نمو البكتيريا في الفم ويقلل من حدوث التهاب اللثة.
س: هل يمكن استخدام كلوريد القصدير لاختزال النيترو إلى أمين؟
ج: نعم، يمكن استخدام SnCl2 كعامل اختزال في تحويل مركبات النيترو إلى مشتقاتها الأمينية المقابلة. يستخدم هذا التفاعل بشكل شائع في الكيمياء العضوية ويمكن تنفيذه في ظل ظروف مختلفة، اعتمادًا على المتطلبات المحددة للتفاعل.
س: ما هو اختبار كلوريد الذهب الستانوس؟
ج: في صناعات التعدين والمعادن، يستخدم المحترفون اختبار الذهب SnCl2 للكشف عن وجود الذهب في عينة معينة. يضيفون SnCl2 إلى العينة، مما يتسبب في ترسيب الذهب خارج المحلول وتكوين لون أرجواني أو بني مميز. ويساعدهم هذا الاختبار في تحديد محتوى الذهب في الخامات والمواد الأخرى.
