كلوريد الألومنيوم أو AlCl3 هو مركب كيميائي يستخدم في العمليات الصناعية المختلفة. وهو يعمل بمثابة حمض لويس، ويحفز تفاعلات التوليف العضوي والبلمرة. كما أن لها خصائص مضادة للتعرق في منتجات العناية الشخصية.
| اسم الأيوباك | ثلاثي كلوريد الألومنيوم |
| الصيغة الجزيئية | AlCl3 |
| CAS رقم | 7446-70-0 |
| المرادفات | ثلاثي كلوريد الألومنيوم، كلوريد الألومنيوم (III)، كلوريد الألومنيوم (III)، كلوريد الألومنيوم، ثلاثي كلورو الألومنيوم |
| إنتشي | InChI=1S/3ClH.Al/h3*1H;/q;;;+3/p-3 |
صيغة كلوريد الألومنيوم
الصيغة الكيميائية لكلوريد الألومنيوم هي AlCl3. تمثل هذه الصيغة عدد ذرات كل عنصر في الجزيء. تعتبر صيغة كلوريد الألومنيوم مهمة لأنها تستخدم لتحديد المادة وحساب خصائصها. تُستخدم الصيغة أيضًا في المعادلات الكيميائية لتمثيل المواد المتفاعلة ومنتجات التفاعل الكيميائي.
الكتلة المولية لكلوريد الألومنيوم
يحتوي كلوريد الألومنيوم على كتلة مولية تبلغ 133.34 جم/مول. يتم حساب هذه القيمة عن طريق إضافة الكتلة الذرية لذرة ألومنيوم واحدة وثلاث ذرات كلور. الصيغة الجزيئية لكلوريد الألومنيوم هي AlCl3، مما يعني أنه يحتوي على ذرة ألومنيوم واحدة وثلاث ذرات كلور. تعتبر الكتلة المولية خاصية مهمة لكلوريد الألومنيوم لأنها تستخدم في العديد من التفاعلات الكيميائية والعمليات الصناعية. تُستخدم الكتلة المولية أيضًا لحساب كمية المادة الموجودة في عينة معينة.
نقطة غليان كلوريد الألومنيوم
نقطة غليان كلوريد الألومنيوم هي 180.8 درجة مئوية (357.4 درجة فهرنهايت). هذه القيمة هي درجة الحرارة التي يتغير عندها الشكل السائل لكلوريد الألومنيوم إلى الحالة الغازية. درجة غليان كلوريد الألومنيوم عالية نسبيًا، مما يجعله مفيدًا في العديد من العمليات الصناعية التي تتطلب درجات حرارة عالية. على سبيل المثال، يتم استخدام كلوريد الألومنيوم كمحفز في تصنيع مادة البولي بروبيلين، وهو بوليمر لدن بالحرارة.
نقطة انصهار كلوريد الألومنيوم
نقطة انصهار كلوريد الألومنيوم هي 194 درجة مئوية (381.2 درجة فهرنهايت). هذه القيمة هي درجة الحرارة التي يتغير عندها الشكل الصلب لكلوريد الألومنيوم إلى الحالة السائلة. درجة انصهار كلوريد الألومنيوم منخفضة نسبيًا، مما يعني أنه يمكن صهره بسهولة واستخدامه في التفاعلات الكيميائية والعمليات الصناعية المختلفة. على سبيل المثال، يستخدم كلوريد الألومنيوم كمادة تخثر في صناعة معالجة المياه.
كثافة كلوريد الألومنيوم جم/مل
تبلغ كثافة كلوريد الألومنيوم 2.44 جم/سم3. هذه القيمة هي كتلة كلوريد الألومنيوم لكل وحدة حجم. تعد كثافة كلوريد الألومنيوم مهمة لأنها تحدد كتلة حجم معين من المادة. تُستخدم كثافة كلوريد الألومنيوم أيضًا لحساب تركيز المادة في المحلول.
هيكل كلوريد الألومنيوم
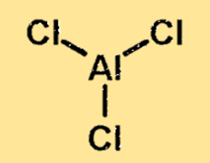
هيكل كلوريد الألومنيوم عبارة عن جزيء مرتبط تساهميًا مع ذرة ألومنيوم واحدة وثلاث ذرات كلور. وتقع ذرة الألومنيوم في وسط الجزيء، وتحيط بها ذرات الكلور الثلاث. يعد هيكل كلوريد الألومنيوم مهمًا لأنه يحدد الخواص الفيزيائية والكيميائية للمادة.
الوزن الجزيئي لكلوريد الألومنيوم
الوزن الجزيئي لكلوريد الألومنيوم هو 133.34 جم / مول. هذه القيمة هي مجموع الأوزان الذرية للذرات الموجودة في الجزيء. يعد الوزن الجزيئي لكلوريد الألومنيوم مهمًا لأنه يستخدم لحساب كمية المادة الموجودة في عينة معينة. تُستخدم هذه القيمة أيضًا لتحديد التركيز المولي للمحلول.
| مظهر | الأبيض إلى الأصفر الصلبة أو مسحوق |
| جاذبية معينة | 2.44 جم/سم3 |
| لون | عديم اللون إلى أصفر شاحب |
| يشم | عديم الرائحة |
| الكتلة المولية | 133.34 جرام/مول |
| كثافة | 2.44 جم/سم3 |
| نقطة الانصهار | 194 درجة مئوية (381.2 درجة فهرنهايت) |
| نقطة الغليان | 180.8 درجة مئوية (357.4 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان جدا في الماء |
| الذوبان | قابل للذوبان في الإيثانول والميثانول والأثير |
| ضغط البخار | 2.67 كيلو باسكال عند 25 درجة مئوية |
| كثافة بخار | 4.45 (الهواء = 1) |
| pKa | -6 |
| الرقم الهيدروجيني | 2.0 (10 جم/لتر، H2O) |
سلامة ومخاطر كلوريد الألومنيوم
يشكل كلوريد الألومنيوم العديد من المخاطر المتعلقة بالسلامة والصحة. وهو مادة أكالة ويمكن أن يسبب تهيجًا شديدًا في الجلد والعين، بالإضافة إلى تهيج الجهاز التنفسي والجهاز الهضمي في حالة ابتلاعه أو استنشاقه. كما يمكن أن يسبب حروقًا إذا لامس الجلد. كلوريد الألومنيوم هو عامل مؤكسد قوي ويمكن أن يتفاعل بعنف مع الماء، ويطلق غاز كلوريد الهيدروجين. كما أنه غير متوافق مع العديد من المركبات العضوية، مثل الكحوليات والأمينات، ويمكن أن يتفاعل معها لإنتاج غازات خطرة. وينبغي ارتداء معدات الحماية المناسبة، بما في ذلك القفازات والنظارات الواقية وجهاز التنفس الصناعي، عند التعامل مع كلوريد الألومنيوم.
| رموز الخطر | تآكل، ضارة |
| وصف الأمان | تجنب ملامسة الجلد والعينين. ارتداء القفازات الواقية وحماية العين/الوجه. في حالة ملامسته، اشطفيه بالكثير من الماء واستشيري الطبيب. لا استوعب أو يستنشق. استخدام في منطقة جيدة التهوية. يُخزن في مكان بارد وجاف بعيدًا عن المواد غير المتوافقة. |
| أرقام تعريف الأمم المتحدة | الأمم المتحدة 1726 |
| رمز النظام المنسق | 2827.32.00 |
| فئة الخطر | 8 |
| مجموعة التعبئة | ثالثا |
| تسمم | سامة إذا ابتلعتها أو استنشقتها. يسبب تهيجًا خطيرًا في الجلد والعين. قد يسبب تهيج الجهاز التنفسي والهضمي. قد يتفاعل بعنف مع الماء، ويطلق غاز كلوريد الهيدروجين. غير متوافق مع العديد من المركبات العضوية، مثل الكحولات والأمينات، وقد يتفاعل معها لينتج غازات خطرة. |
طرق تصنيع كلوريد الألومنيوم
يمكن تصنيع كلوريد الألومنيوم بطرق مختلفة مثل التوليف المباشر والتحلل المائي وتفاعل الألومنيوم مع كلوريد الهيدروجين.
- يتضمن التوليف المباشر تفاعل الألومنيوم مع غاز الكلور عند درجات حرارة عالية، عادة حوالي 700-800 درجة مئوية. تفاعل الألومنيوم مع كلوريد الهيدروجين يولد كلوريد الألومنيوم في الطور الغازي، والذي يمكن تكثيفه إلى شكل سائل.
- يتضمن التحلل المائي تفاعل الألومنيوم المعدني مع حمض الهيدروكلوريك أو الماء، مما ينتج عنه غاز الهيدروجين وكلوريد الألومنيوم. يكون تفاعل التحلل المائي طاردًا للحرارة بشكل عام ويمكن أن يكون خطيرًا إذا لم يتم إجراؤه بشكل صحيح.
- يعد تفاعل الألومنيوم مع غاز كلوريد الهيدروجين طريقة أخرى لتصنيع كلوريد الألومنيوم. يحدث هذا التفاعل في درجة حرارة الغرفة وينتج غاز الهيدروجين وكلوريد الألومنيوم.
- هناك طريقة شائعة أخرى لتصنيع كلوريد الألومنيوم وهي تفاعل أكسيد الألومنيوم مع حمض الهيدروكلوريك. ينتج عن هذا التفاعل كلوريد الألومنيوم والماء كمنتجات.
- يعد تفاعل الألومنيوم مع خليط من غاز الكلور وأول أكسيد الكربون طريقة أخرى لتصنيع كلوريد الألومنيوم. يحدث هذا التفاعل عند درجات حرارة عالية وينتج كلوريد الألومنيوم وثاني أكسيد الكربون.
بشكل عام، يتطلب تصنيع كلوريد الألومنيوم معالجة دقيقة والتحكم في ظروف التفاعل لضمان عملية آمنة وفعالة.
استخدامات كلوريد الألومنيوم
كلوريد الألومنيوم له استخدامات عديدة في مختلف الصناعات بسبب خصائصه الفريدة.
- تفاعلات الكيمياء العضوية، بما في ذلك إنتاج البوليمرات والمستحضرات الصيدلانية والعطور، تستخدم عادة كلوريد الألومنيوم كمحفز.
- معالجة مياه الشرب ومياه الصرف الصحي لإزالة المواد الصلبة العالقة غالبا ما تنطوي على استخدام كلوريد الألومنيوم كمادة تخثر.
- يستفيد إنتاج الألومنيوم والسبائك من استخدام كلوريد الألومنيوم كتدفق، مما يساعد على إزالة الشوائب وتحسين عملية الصب.
- وفي صناعة البتروكيماويات، يعمل كلوريد الألومنيوم كمحفز في إنتاج البنزين والمواد الهيدروكربونية الأخرى. بالإضافة إلى ذلك، يتم استخدامه كمزيل للعرق ومضاد للتعرق في منتجات العناية الشخصية.
- تستخدم بعض الأدوية المتاحة دون وصفة طبية كلوريد الألومنيوم، الذي يتمتع بخصائص قابضة، لعلاج تهيج الجلد الطفيف ووقف النزيف. يستخدم كلوريد الألومنيوم أيضًا لعلاج فرط التعرق، وهي حالة تتميز بالتعرق الزائد.
- تستخدم صناعة النسيج كلوريد الألومنيوم كمادة لاصقة للمساعدة في ربط الأصباغ بالأقمشة، ويستخدم أيضًا في إنتاج المطاط الصناعي.
بشكل عام، يجد كلوريد الألومنيوم استخدامات متنوعة ومهمة في العديد من الصناعات، مما يسلط الضوء على أهميته في العالم الحديث.
أسئلة:
س: أيهما أفضل مقارنة بين 1 مول من كلوريد الصوديوم و 1 مول من كلوريد الألومنيوم؟
ج: 1 مول من كلوريد الصوديوم (NaCl) و1 مول من كلوريد الألومنيوم (AlCl3) يحتويان على 1 مول من أيونات الكلوريد، لكن كلوريد الألومنيوم يحتوي على كاتيونات أكثر بثلاث مرات من كلوريد الصوديوم.
س: هل كلوريد الألومنيوم مائي؟
ج: يمكن أن يتواجد كلوريد الألومنيوم في صورتين صلبة ومائية. عندما يذوب في الماء، فإنه يشكل محلول حمضي للغاية بسبب التحلل المائي لكاتيون الألومنيوم.
س: ما هي الصيغة الصحيحة لكلوريد الألومنيوم؟
ج: الصيغة الصحيحة لكلوريد الألومنيوم هي AlCl3. يشير هذا إلى أن كل جزيء من كلوريد الألومنيوم يحتوي على كاتيون ألومنيوم واحد (Al3+) وثلاثة أنيونات كلوريد (Cl-).
س: هل كلوريد الألومنيوم آمن؟
ج: يمكن أن يكون كلوريد الألومنيوم خطيرًا إذا لم يتم التعامل معه بشكل صحيح. قد يسبب تهيج الجلد والعين، وتهيج الجهاز التنفسي والجهاز الهضمي وقد يكون سامًا في حالة ابتلاعه أو استنشاقه. وينبغي تخزينها والتعامل معها في منطقة جيدة التهوية ومع معدات الحماية المناسبة.
س: ما عدد أيونات الكلوريد الموجودة في 1.50 مول من كلوريد الألومنيوم؟
ج: بما أن صيغة كلوريد الألومنيوم هي AlCl3، فإن كل جزيء يحتوي على ثلاثة أيونات كلوريد. ولذلك فإن 1.50 مول من كلوريد الألومنيوم يحتوي على 1.50 × 3 = 4.50 مول من أيونات الكلوريد.
