كربونات النحاس (CuCO3) عبارة عن مركب أخضر مزرق يتكون بشكل طبيعي من تفاعل أملاح النحاس مع أيونات الكربونات. وله تطبيقات صناعية مختلفة، بما في ذلك الأصباغ ومبيدات الفطريات.
| اسم الأيوباك | كربونات النحاس (II). |
| الصيغة الجزيئية | CuCO3 |
| CAS رقم | 1184-64-1 |
| المرادفات | كربونات النحاس الأساسية، كربونات النحاس، أحادي كربونات النحاس |
| إنتشي | InChI=1S/CH2O3.Cu/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 |
خصائص كربونات النحاس
صيغة كربونات النحاس
الصيغة الكيميائية لكربونات النحاسيك هي CuCO3. وهو يمثل مزيجًا من ذرة نحاس واحدة (Cu)، وذرة كربون واحدة (C) وثلاث ذرات أكسجين (O). توفر هذه الصيغة معلومات مهمة حول التركيب العنصري للمركب.
الكتلة المولية لكربونات النحاس
تحتوي كربونات النحاسيك على كتلة مولية تبلغ حوالي 123.55 جرام لكل مول (جم/مول). الكتلة المولية هي مجموع الكتل الذرية لجميع الذرات الموجودة في المول من المادة ويتم التعبير عنها بالجرام لكل مول.
نقطة غليان كربونات النحاس
ليس لدى كربونات النحاسيك نقطة غليان مميزة لأنها تتحلل إلى CuO وثاني أكسيد الكربون عند تسخينها إلى حوالي 200 درجة مئوية. ولذلك، فإنه يخضع للتحلل الحراري بدلا من الغليان.
نقطة انصهار كربونات النحاس
كربونات النحاسيك لديها نقطة انصهار تبلغ حوالي 200 درجة مئوية (392 درجة فهرنهايت). عند درجة الحرارة هذه، تتحول كربونات النحاسيك الصلبة إلى الحالة السائلة. لكن تجدر الإشارة إلى أنه يتحلل قبل أن يصل إلى درجة الغليان.
كثافة كربونات النحاس جم/مل
تبلغ كثافة كربونات النحاسيك حوالي 3.6 جرام لكل ملليلتر (جم / مل). تقيس الكثافة كتلة المادة لكل وحدة حجم، مما يشير إلى مدى تقارب جزيئاتها معًا.
الوزن الجزيئي لكربونات النحاس
يبلغ الوزن الجزيئي لكربونات النحاسيك، والذي يُسمى أيضًا الكتلة المولية، حوالي 123.55 جم/مول. هذه القيمة ضرورية لمختلف الحسابات والتحويلات الكيميائية.
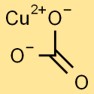
هيكل كربونات النحاس
تتبنى كربونات النحاسيك هيكل مستو ثلاثي الزوايا. وتحيط بذرة النحاس المركزية ثلاث ذرات أكسجين ومجموعة كربونات، مكونة من ذرة كربون واحدة وثلاث ذرات أكسجين مرتبطة ببعضها البعض.
ذوبان كربونات النحاس
كربونات النحاسيك ضعيفة الذوبان في الماء، مما يعني أنها تذوب بدرجة محدودة فقط. تتأثر الذوبان بعوامل مثل درجة الحرارة ودرجة الحموضة. يتفاعل مع الأحماض لتكوين أملاح النحاس ويطلق ثاني أكسيد الكربون.
| مظهر | الصلبة الأزرق والأخضر |
| جاذبية معينة | ~3.6 جم/مل |
| لون | أزرق أخضر |
| يشم | عديم الرائحة |
| الكتلة المولية | ~123.55 جم/مول |
| كثافة | ~3.6 جم/مل |
| نقطة الانصهار | ~200 درجة مئوية (392 درجة فهرنهايت) |
| نقطة الغليان | يتحلل عند ~ 200 درجة مئوية |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | ضعيف الذوبان، ويتأثر بدرجة الحرارة ودرجة الحموضة |
| الذوبان | غير قابل للذوبان في معظم المذيبات |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | قلوية (أساسية) |
سلامة ومخاطر كربونات النحاس
تطرح كربونات النحاسيك اعتبارات معينة تتعلق بالسلامة والمخاطر. ومن الضروري التعامل معها بعناية لتجنب المخاطر المحتملة. الاتصال المباشر بالجلد أو العينين أو استنشاق الغبار قد يسبب تهيجًا وعدم الراحة. قد يكون التعرض أو الابتلاع لفترة طويلة ضارًا ويؤدي إلى مشاكل صحية أكثر خطورة. يمكن أن تطلق أبخرة سامة، بما في ذلك ثاني أكسيد الكربون، عند تسخينها، مما يتطلب تهوية كافية. بالإضافة إلى ذلك، فإن كربونات النحاسيك قابلة للاشتعال في شكل مسحوق، مما يتطلب التخزين والتعامل بعناية لتجنب مخاطر الحريق. لضمان السلامة، اتبع دائمًا احتياطات السلامة، وارتداء معدات الحماية المناسبة، وقم بتخزين المركبات بعيدًا عن المواد غير المتوافقة.
| رموز الخطر | مزعجة وخطيرة |
| وصف الأمان | التعامل مع الرعاية. تجنب الاتصال المباشر. استخدام في مناطق جيدة التهوية. اتبع تعليمات السلامة وارتداء معدات الحماية. |
| أرقام تعريف الأمم المتحدة | لا ينسب |
| رمز النظام المنسق | 2836.40.0000 |
| فئة الخطر | غير مصنف |
| مجموعة التعبئة | غير قابل للتطبيق |
| تسمم | سمية منخفضة. قد يسبب تهيجًا وعدم راحة عند التلامس؛ تجنب الابتلاع والاستنشاق. |
طرق تصنيع كربونات النحاس
هناك طرق مختلفة لتصنيع كربونات النحاسيك، تتضمن جميعها مزيجًا من أملاح النحاس ومصادر الكربونات. الطريقة الشائعة هي تفاعل CuSO4 مع كربونات الصوديوم (Na2CO3) في محلول مائي. ينتج عن هذا التفاعل راسب من كربونات النحاسيك، ويتم فصله بالترشيح، يليه التجفيف للحصول على المنتج الصلب.
تتضمن الطريقة الأخرى تفاعل CuCl2 مع كربونات الصوديوم أو بيكربونات الصوديوم (NaHCO3) في بيئة مائية مماثلة. ينتج عن هذا التفاعل كربونات النحاسيك وكلوريد الصوديوم (NaCl) كمنتج ثانوي.
بالإضافة إلى ذلك، يشكل غليان ثاني أكسيد الكربون (CO2) من خلال محلول Cu(OH)2 راسبًا من كربونات النحاسيك عند تحويل الهيدروكسيد.
يتفاعل معدن النحاس مع غاز ثاني أكسيد الكربون في بيئة خاضعة للرقابة لإنتاج كربونات النحاس.
يصبح التحكم في ظروف التفاعل، مثل درجة الحرارة والتركيز، أمرًا بالغ الأهمية لتحقيق النتائج والنقاء المطلوبين. توفر هذه الطرق وسيلة لإنتاج كربونات النحاسيك لمختلف التطبيقات الصناعية، بما في ذلك استخدامه كأصباغ أو مبيد للفطريات أو في العمليات الكيميائية الأخرى.
استخدامات كربونات النحاس
تجد كربونات النحاس تطبيقات متعددة الاستخدامات في مختلف الصناعات نظرًا لخصائصها الفريدة. فيما يلي بعض الاستخدامات الرئيسية لكربونات النحاسيك:
- الأصباغ: تضفي كربونات النحاسيك على نطاق واسع ألوانًا زرقاء وخضراء نابضة بالحياة على الدهانات والسيراميك والبلاستيك، مما يحسن مظهرها.
- مبيد الفطريات الزراعية: يعمل بشكل فعال كمبيد للفطريات في الزراعة، حيث يحمي المحاصيل من الالتهابات الفطرية ويعزز نمو النبات الصحي.
- الحفاظ على الخشب: تستخدم كربونات النحاس في تركيبات حافظة الخشب، مما يحمي الخشب من التعفن وتلف الحشرات.
- الطلاء الكهربائي: يسهل بشكل كبير عمليات الطلاء الكهربائي، مما يتيح ترسيب طلاء النحاس على الأسطح المعدنية المختلفة، وبالتالي تحسين التوصيل ومقاومة التآكل.
- المحفز: تعمل كربونات النحاس كمحفز نشط في العديد من التفاعلات الكيميائية، مما يؤدي إلى تسريع معدلات التفاعل دون إجراء تغييرات كبيرة في حد ذاتها.
- مبيد الطحالب: في معالجة المياه، يعمل بفعالية كمبيد للطحالب، حيث يتحكم في نمو الطحالب في الخزانات والبرك وأنظمة المياه.
- صناعة الزجاج: تساهم كربونات النحاس بشكل فعال في إنتاج منتجات الزجاج الملون باللون الأخضر مثل الزجاجات والأواني الزجاجية المزخرفة في صناعة الزجاج.
- المجوهرات الاصطناعية: يشتمل إنتاج المجوهرات الاصطناعية على كربونات النحاس، مما يوفر بديلاً ميسور التكلفة للمجوهرات الحقيقية المعتمدة على النحاس.
- الكيمياء التحليلية: تجد كربونات النحاس استخدامًا نشطًا ككاشف في الكيمياء التحليلية لإجراء الاختبارات والتجارب المختلفة.
- الألعاب النارية والألعاب النارية: تساهم بشكل فعال في إضفاء اللون الأخضر الساطع على الألعاب النارية وعروض الألعاب النارية.
يسلط تنوع التطبيقات الضوء على أهمية كربونات النحاس كمركب كيميائي قيم في العديد من الصناعات، مما يؤدي إلى تحسين المنتجات والعمليات.
أسئلة:
س: ما عدد مولات ذرات الأكسجين الموجودة في 5.67 مول من كربونات النحاس الثنائي؟
ج: في 5.67 مول من كربونات النحاس الثنائي يوجد 17.01 مول من ذرات الأكسجين (3 ذرات أكسجين لكل 1 مول من CuCO3).
س: هل كربونات النحاس قابلة للذوبان؟
ج: كربونات النحاس قليلة الذوبان في الماء.
س: ما هو العنصر الأكثر قدرة على توصيل الكهرباء: النحاس أم الكربون أم الهيليوم أم الكبريت؟
ج: النحاس هو العنصر الأكثر قدرة على تمرير الكهرباء لأنه موصل جيد للكهرباء.
س: كيفية صنع كربونات النحاس؟
ج: يمكن تحضير كربونات النحاسيك عن طريق تفاعل أملاح النحاس مع مصادر الكربونات، مثل كربونات الصوديوم، أو عن طريق غلي ثاني أكسيد الكربون من خلال محلول Cu(OH)2.
س: كيفية استخدام كربونات النحاس في صناعة الفخار؟
ج: يتم استخدام كربونات النحاس في صناعة الفخار كطبقة زجاجية للسيراميك لإضافة اللون الأزرق والأخضر إلى القطع النهائية.
س: هل CuCO3 قابل للذوبان في الماء؟
ج: CuCO3 قليل الذوبان في الماء.
س: كيف يمكنك استخدام تفاعل الترسيب لتحضير عينة CuCO3؟
ج: لتحضير CuCO3 عن طريق تفاعل الترسيب، يمكنك خلط ملح النحاس القابل للذوبان مع ملح كربونات قابل للذوبان، مما يؤدي إلى تكوين كربونات النحاسيك غير القابلة للذوبان، والتي يمكن فصلها عن طريق الترشيح.
س: ما اسم المركب CuCO3 ؟
ج: يُسمى المركب CuCO3 بكربونات النحاسيك (II).
س: ما هي الكتلة المولية لـ CuCO3؟
ج: تبلغ الكتلة المولية لـ CuCO3 حوالي 123.55 جم/مول.
س: هل CuCO3 قابل للذوبان أم غير قابل للذوبان؟
ج: CuCO3 غير قابل للذوبان في معظم المذيبات، بما في ذلك الماء.
س: مما تتكون كربونات النحاس (II)؟
ج: تتكون كربونات النحاس (II) من ذرة Cu واحدة، وذرة كربون واحدة (C)، وثلاث ذرات أكسجين (O).
