كبريتات النيكل (NiSO4) مركب يتكون من ذرات النيكل والكبريت والأكسجين. ويشيع استخدامه في الطلاء الكهربائي، والمحفزات وكمواد مغذية في بعض الأسمدة.
| اسم الأيوباك | كبريتات النيكل (II). |
| الصيغة الجزيئية | نيسو4 |
| CAS رقم | 7786-81-4 |
| المرادفات | كبريتات النيكل، ملح النيكل من حامض الكبريتيك، كبريتات النيكل (II)، النيكل (2+)؛ كبريتات |
| إنتشي | InChI=1S/Ni.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
خصائص كبريتات النيكل
صيغة كبريتات النيكل
الصيغة الكيميائية لكبريتات النيكل هي NiSO4. وهو يمثل مزيج من ذرة النيكل (Ni) ومجموعة الكبريتات (SO4). تشير الصيغة بوضوح إلى وجود النيكل والكبريت وكذلك الأكسجين في مجموعة الكبريتات.
كبريتات النيكل الكتلة المولية
يتم حساب الكتلة المولية لكبريتات النيكل (NiSO4) عن طريق إضافة الكتل الذرية للعناصر المكونة لها. يحتوي النيكل (Ni) على كتلة ذرية تبلغ حوالي 58.69 جرامًا لكل مول، بينما تبلغ الكتلة الذرية للكبريت (S) حوالي 32.07 جرامًا لكل مول، والأكسجين (O) لديه كتلة ذرية حوالي 16 جرامًا لكل مول. وبإضافة هذه القيم، يتم تحديد الكتلة المولية لكبريتات النيكل بحوالي 154.76 جرامًا لكل مول.
درجة غليان كبريتات النيكل
ليس لدى كبريتات النيكل نقطة غليان محددة لأنها تتحلل عند تسخينها. ومع ذلك، فمن المهم أن نلاحظ أن درجة حرارة تحللها تتأثر بعوامل مثل الضغط ووجود مواد أخرى. لذلك ينصح بالتعامل بحذر مع كبريتات النيكل عند تعرضها لدرجات حرارة عالية.
نقطة انصهار كبريتات النيكل
تبلغ نقطة انصهار كبريتات النيكل حوالي 100 درجة مئوية (212 درجة فهرنهايت). عند درجة الحرارة هذه، يتغير الشكل الصلب لكبريتات النيكل إلى الحالة السائلة. ومن الجدير بالذكر أن الاختلافات في النقاء والتركيب البلوري لكبريتات النيكل يمكن أن تؤثر بشكل طفيف على نقطة انصهارها.
كثافة كبريتات النيكل جم/مل
تشير كثافة كبريتات النيكل إلى كتلتها لكل وحدة حجم. تبلغ كثافة كبريتات النيكل عادة حوالي 3.68 جرام لكل مليلتر (جم / مل). وتجدر الإشارة إلى أن الكثافة يمكن أن تختلف تبعا لدرجة الحرارة ونقاء العينة.
الوزن الجزيئي لكبريتات النيكل
الوزن الجزيئي لكبريتات النيكل (NiSO4) هو مجموع الأوزان الذرية للعناصر المكونة لها. كما ذكرنا سابقًا، يبلغ الوزن الجزيئي لكبريتات النيكل حوالي 154.76 جرامًا لكل مول.
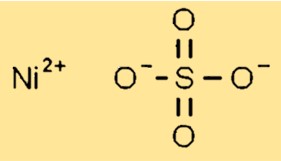
هيكل كبريتات النيكل
كبريتات النيكل لها بنية بلورية في الحالة الصلبة. وهي تشكل بلورات أحادية الميل مع كل أيون نيكل (Ni2+) محاط بست ذرات أكسجين من مجموعات الكبريتات. يتم ترتيب مجموعات الكبريتات بطريقة تسمح بضغط الشبكة البلورية بكفاءة.
ذوبان كبريتات النيكل
كبريتات النيكل لديها ذوبان معتدل في الماء. يذوب بسهولة في الماء، وتزداد قابليته للذوبان مع ارتفاع درجة الحرارة. وجود الأيونات والمواد الأخرى يمكن أن يؤثر على ذوبانه. بالإضافة إلى ذلك، يمكن أن تشكل كبريتات النيكل هيدرات عند دمجها مع جزيئات الماء، مما يؤدي إلى تكوين هيدرات كبريتات النيكل المختلفة.
| مظهر | بلورات زرقاء/خضراء |
| جاذبية معينة | 3.68 جرام/مل |
| لون | أزرق أخضر |
| يشم | عديم الرائحة |
| الكتلة المولية | 154.76 جرام/مول |
| كثافة | 3.68 جرام/مل |
| نقطة الانصهار | 100 درجة مئوية (212 درجة فهرنهايت) |
| نقطة الغليان | متحللة |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان للغاية |
| الذوبان | قابل للذوبان في الماء والمذيبات العضوية مثل الإيثانول |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | -1.1 (حمض الكبريتيك) |
| الرقم الهيدروجيني | حمض (حوالي 4) |
السلامة ومخاطر كبريتات النيكل
تشكل كبريتات النيكل بعض مخاطر السلامة التي يجب أخذها في الاعتبار. ومن الضروري التعامل معها بعناية لتجنب المخاطر المحتملة. يجب التقليل من ملامسة الجلد المباشرة، لأنه قد يسبب تهيج الجلد أو حساسيته. يجب تجنب تناول أو استنشاق كبريتات النيكل، لأنها قد تسبب آثارًا صحية ضارة. عند العمل باستخدام كبريتات النيكل، يجب ارتداء معدات الحماية الشخصية المناسبة، مثل القفازات والنظارات الواقية، لتجنب ملامسة المادة. يجب تخزين كبريتات النيكل في مكان بارد وجاف بعيدا عن المواد غير المتوافقة. تعتبر التهوية الكافية ضرورية عند العمل مع كبريتات النيكل لتقليل تركيز الجزيئات المحمولة بالهواء.
| رموز الخطر | لا أحد |
| وصف الأمان | – تجنب ملامسته للبشرة – تجنب الابتلاع والاستنشاق – ارتداء معدات الحماية الشخصية المناسبة |
| معرفات الأمم المتحدة | غير قابل للتطبيق |
| رمز النظام المنسق | 2833.25 |
| فئة الخطر | غير مصنف |
| مجموعة التعبئة | غير قابل للتطبيق |
| تسمم | قد يسبب تهيج الجلد أو تحسسه |
طرق تصنيع كبريتات النيكل
هناك طرق مختلفة لتجميع كبريتات النيكل.
يتضمن النهج الشائع التفاعل بين النيكل المعدني أو أكسيد النيكل مع حمض الكبريتيك . في هذه الطريقة، يقوم حمض الكبريتيك بإذابة النيكل المعدني أو أكسيد النيكل، مما يؤدي إلى تكوين كبريتات النيكل. يمكنك إجراء التفاعل تحت ظروف خاضعة للرقابة، مثل درجة الحرارة والتحريك، لضمان التحويل الفعال.
تتضمن الطريقة الأخرى تفاعل حمض الكبريتيك مع كربونات النيكل. يذيب حمض الكبريتيك كربونات النيكل وينتج كبريتات النيكل. عادةً ما يستخدم الكيميائيون هذه الطريقة عندما يكون لديهم كربونات النيكل متاحة بسهولة، لأنها توفر مادة بداية مناسبة.
بالإضافة إلى ذلك، يمكن لحمض الكبريتيك إذابة هيدروكسيد النيكل لتصنيع NiSO4. يؤدي ذوبان هيدروكسيد النيكل في حامض الكبريتيك إلى تكوين NiSO4. هذه الطريقة مناسبة عندما يرغب المرء في استخدام هيدروكسيد النيكل كمقدمة لتخليق كبريتات النيكل.
من المهم ملاحظة أنه يجب عليك اتباع احتياطات السلامة المناسبة أثناء عملية التوليف. ويشمل ذلك استخدام معدات الحماية المناسبة وإجراءات المناولة. قم بإجراء التفاعلات في منطقة جيدة التهوية لتقليل مخاطر التعرض للأبخرة الضارة. يعد التحكم الدقيق في معلمات التفاعل، مثل درجة الحرارة والتركيز، أمرًا بالغ الأهمية لضمان التحويل الأمثل لكبريتات النيكل وإنتاجيتها.
استخدامات كبريتات النيكل
لكبريتات النيكل تطبيقات مختلفة في صناعات مختلفة. فيما يلي بعض استخداماته الشائعة:
- الطلاء الكهربائي: تستخدم عمليات الطلاء الكهربائي على نطاق واسع كبريتات النيكل لإنشاء طلاء متين ومقاوم للتآكل على الأسطح المعدنية. تعمل كبريتات النيكل على تحسين مظهر وصلابة وقوة العناصر مثل المجوهرات وقطع غيار السيارات وأدوات المطبخ.
- المحفز: تعمل كبريتات النيكل كمحفز في العديد من التفاعلات الكيميائية، بما في ذلك عمليات الهدرجة والأكسدة. تستخدم الصناعات محفزات كبريتات النيكل في إنتاج الأدوية والبتروكيماويات والمواد الكيميائية الدقيقة.
- البطاريات: البطاريات القابلة لإعادة الشحن، وخاصة بطاريات Ni-Cd وNi-MH، تحتوي على كبريتات النيكل كمكون أساسي. تسهل كبريتات النيكل تفاعلات القطب الكهربائي وتضمن تخزين وإطلاق الطاقة الكهربائية بكفاءة.
- الأسمدة: تستخدم بعض الأسمدة النيكل القابل للذوبان من كبريتات النيكل لتزويد النباتات بالعناصر الغذائية الأساسية. يلعب النيكل دورًا حاسمًا في عمليات التمثيل الغذائي المختلفة في النباتات، مما يساهم في نموها وتطورها.
- المنسوجات: تستخدم صناعة النسيج كبريتات النيكل في عمليات الصباغة والطباعة لتحسين ثبات اللون وامتصاص الصبغة للأقمشة. تضمن كبريتات النيكل نتائج ألوان نابضة بالحياة وطويلة الأمد.
- المستحضرات الصيدلانية: تجد كبريتات النيكل تطبيقات في المستحضرات الصيدلانية، وذلك بشكل رئيسي لإنتاج الأدوية التي تحتوي على النيكل كعنصر نشط أو لصياغة مجمعات النيكل المحددة المستخدمة في الأبحاث الطبية.
- البحث والتطوير: تستخدم المختبرات كبريتات النيكل لمجموعة متنوعة من أغراض البحث والتطوير، بما في ذلك التركيب الكيميائي، والدراسات الكهروكيميائية، وأبحاث علوم المواد.
أسئلة:
س: ما هي صيغة كبريتات النيكل (II)؟
ج: صيغة كبريتات النيكل (II) هي NiSO4.
س: يضاف الكروم الفلزي إلى محلول كبريتات النيكل (II). ما هو التفاعل الكيميائي المتوازن؟
ج: التفاعل الكيميائي المتوازن هو: Cr + NiSO4 -> CrSO4 + Ni.
س: كيفية صنع كبريتات الأمونيوم النيكل؟
ج: يمكن تحضير كبريتات النيكل الأمونيوم عن طريق إذابة كبريتات النيكل وكبريتات الأمونيوم في الماء، ثم التبلور.
س: هل كبريتات النيكل قابلة للذوبان في الماء؟
ج: نعم، كبريتات النيكل قابلة للذوبان في الماء.
س: من يستخرج كبريتات النيكل؟
ج: لا يتم استخراج كبريتات النيكل مباشرة. يتم استخراج خامات النيكل ويمكن إنتاج كبريتات النيكل منها.
س: ما اسم المركب NiSO4؟
ج: المركب NiSO4 يسمى كبريتات النيكل.
س: ما عدد جرامات NiSO4 الموجودة في 100 جرام من الهيدرات؟ كم عدد الشامات؟
ج: تعتمد كمية NiSO4 في 100 جم من الهيدرات على مركب الهيدرات المحدد وكتلته المولية.
س: هل NiSO4 قابل للذوبان في الماء؟
ج: نعم، NiSO4 قابل للذوبان في الماء.
س: ما عدد جرامات NiSO4 التي يتم الحصول عليها إذا كان الناتج 76.9%؟
ج: تعتمد جرامات NiSO4 التي تم الحصول عليها على الكمية الأولية وظروف التفاعل.
س: هل NiSO4 خطير؟
ج: يمكن أن يكون NiSO4 خطيرًا إذا لم يتم التعامل معه بشكل صحيح. من المهم اتباع تعليمات السلامة عند العمل معها.
س: ما اسم المركب التساهمي NiSO4؟
ج: NiSO4 ليس مركبًا تساهميًا. وهو مركب أيوني يسمى كبريتات النيكل.
س: هل NiSO4 ملح؟
ج: نعم يعتبر NiSO4 ملحا نظرا لطبيعته الأيونية وتكوينه من التفاعل بين حمض (حمض الكبريتيك) وقاعدة (هيدروكسيد النيكل).
س: ما هي شحنة NiSO4؟
ج: في NiSO4، يحمل أيون النيكل (Ni2+) شحنة موجبة 2+، بينما يحمل أيون الكبريتات (SO4 2-) شحنة سالبة 2-.
