فوسفات البوتاسيوم (K3PO4) هو مركب يحتوي على عنصري البوتاسيوم والفوسفور. يستخدم عادة كمضافات غذائية وأسمدة بسبب قابليته العالية للذوبان وقدرته على توفير العناصر الغذائية الأساسية لنمو النبات.
| اسم الأيوباك | فوسفات البوتاسيوم |
| الصيغة الجزيئية | K3PO4 |
| CAS رقم | 7778-53-2 |
| المرادفات | فوسفات ثلاثي البوتاسيوم، أورثوفوسفات البوتاسيوم، فوسفات البوتاسيوم الثلاثي، أحادي فوسفات ثلاثي البوتاسيوم، فوسفات البوتاسيوم تريباسيك |
| إنتشي | InChI=1S/3K.H3O4P/c;;;1-5(2,3)4/h;;;(H3,1,2,3,4)/q3*+1;/p-3 |
خصائص فوسفات البوتاسيوم
صيغة فوسفات البوتاسيوم
الصيغة الكيميائية لفوسفات البوتاسيوم هي K3PO4. يشير هذا إلى أن المركب يحتوي على ثلاثة أيونات K+ وأيون PO43- واحد في كل وحدة صيغة. تعتبر صيغة فوسفات البوتاسيوم مفيدة في تحديد قياس العناصر الكيميائية للتفاعلات التي تتضمن المركب، وكذلك تحديد كمية كل عنصر موجود في كتلة معينة من المركب.
فوسفات البوتاسيوم الكتلة المولية
الكتلة المولية لـ K3PO4 هي 212.27 جم/مول. ويتم حسابه بإضافة الكتل الذرية للبوتاسيوم والفوسفور والأكسجين إلى المركب. تعد الكتلة المولية معلمة مهمة لتحديد كمية المادة الموجودة في كتلة معينة من المركب. ومن المفيد أيضًا حساب قياس العناصر الكيميائية للتفاعلات التي تتضمن K3PO4.
نقطة غليان فوسفات البوتاسيوم
درجة غليان K3PO4 هي 1660 درجة مئوية. ترجع نقطة الغليان العالية هذه إلى الروابط الأيونية القوية بين أيونات K+ وأيونات PO43- في المركب. كما أنه مؤشر على ثبات المركب عند درجات الحرارة المرتفعة. تعتبر نقطة غليان K3PO4 مفيدة في العديد من التطبيقات الصناعية، مثل إنتاج السيراميك والزجاج.
نقطة انصهار فوسفات البوتاسيوم
نقطة انصهار K3PO4 هي 1340 درجة مئوية. هذه هي درجة الحرارة التي يتحول عندها المركب الصلب إلى الحالة السائلة. تعود نقطة الانصهار العالية لـ K3PO4 إلى الطبيعة الأيونية للمركب، والتي تتطلب كمية كبيرة من الطاقة للتغلب على قوى التجاذب بين الأيونات. تعتبر نقطة انصهار K3PO4 مفيدة في تحديد مدى ملاءمتها لمختلف التطبيقات، مثل إنتاج الأسمدة والمضافات الغذائية.
كثافة فوسفات البوتاسيوم جم / مل
تبلغ كثافة K3PO4 2.564 جم / مل عند درجة حرارة الغرفة. ترجع الكثافة العالية للمركب إلى وجود ثلاثة أيونات K+ وأيون PO43- واحد في كل وحدة صيغة. تعد كثافة K3PO4 مفيدة في تحديد قابلية ذوبانه وسلوكه في العمليات الصناعية المختلفة، مثل إنتاج الأسمدة والمضافات الغذائية.
الوزن الجزيئي لفوسفات البوتاسيوم
الوزن الجزيئي لـ K3PO4 هو 212.27 جم / مول. وهو مجموع الأوزان الذرية لجميع الذرات الموجودة في المركب. الوزن الجزيئي مفيد لحساب كمية المادة الموجودة في كتلة معينة من المركب، وكذلك تحديد قياس العناصر الكيميائية للتفاعلات التي تنطوي على K3PO4.
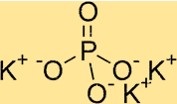
هيكل فوسفات البوتاسيوم
يحتوي K3PO4 على بنية بلورية تقويمية. وهو يتألف من مجموعة من رباعيات الأسطح PO4، حيث يتشارك كل أيون فوسفات ذرتي أكسجين مع أيونات الفوسفات المجاورة. وتقع أيونات البوتاسيوم بين رباعي السطوح الفوسفات، وتحيط بها ذرات الأكسجين. هيكل K3PO4 مفيد لفهم خصائصه، مثل قابليته للذوبان والاستقرار الحراري.
| مظهر | مسحوق بلوري أبيض |
| كثافة محددة | 2,564 جم/مل |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 212.27 جرام/مول |
| كثافة | 2,564 جم/مل |
| نقطة الانصهار | 1340 درجة مئوية |
| نقطة الغليان | 1660 درجة مئوية |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | 100 جم/لتر (20 درجة مئوية) |
| الذوبان | قابل للذوبان في الإيثانول والأسيتون، غير قابل للذوبان في الأثير |
| ضغط البخار | ضئيلة |
| كثافة بخار | غير قابل للتطبيق |
| pKa | pKa1 = 2.16، pKa2 = 7.21، pKa3 = 12.32 |
| الرقم الهيدروجيني | الرقم الهيدروجيني لمحلول 1٪ هو 11.5 |
سلامة ومخاطر فوسفات البوتاسيوم
يعتبر K3PO4 بشكل عام آمنًا للاستخدام عند التعامل معه بشكل صحيح. ومع ذلك، مثل أي مادة كيميائية، يمكن أن تشكل مخاطر إذا تم التعامل معها بشكل خاطئ أو تناولها بكميات كبيرة. يُصنف المركب على أنه مهيج للجلد والعين والجهاز التنفسي وقد يسبب حروقًا شديدة أو ضيقًا في التنفس إذا تم استنشاقه أو تناوله بتركيزات عالية. كما أنه غير متوافق مع الأحماض والعوامل المؤكسدة وقد يسبب حريقاً أو انفجاراً إذا تعرض لهذه المواد. لذلك، من المهم التعامل مع K3PO4 بحذر، وارتداء معدات الحماية المناسبة، وتخزينه في منطقة باردة وجافة وجيدة التهوية بعيدًا عن المواد غير المتوافقة.
| رموز الخطر | شي (مزعج) |
| وصف الأمان | تجنب ملامسة الجلد والعينين. |
| أرقام تعريف الأمم المتحدة | رقم الأمم المتحدة 2833 (لللامائي)، رقم الأمم المتحدة 2423 (لثلاثي الهيدرات) |
| رمز النظام المنسق | 28352400 |
| فئة الخطر | 6.1 (سام) |
| مجموعة التعبئة | ثالثا |
| تسمم | الجرعة المميتة 50 (عن طريق الفم، للفئران): 2340 ملغم/كغم؛ التركيز المميت للنصف (استنشاق، الفئران): 50 ملغم/لتر |
طرق تصنيع فوسفات البوتاسيوم (K3PO4)
توجد عدة طرق لتصنيع K3PO4، بما في ذلك تفاعل حمض الفوسفوريك (H3PO4) مع هيدروكسيد البوتاسيوم (KOH) أو التحلل الحراري لـ KH2PO4.
تتضمن إحدى الطرق تفاعل كميات متساوية المولية من KOH و H3PO4 في الماء عند درجة حرارة تتراوح بين 60 إلى 80 درجة مئوية تقريبًا. يتضمن الإجراء تبخير الخليط الناتج وتسخين البقايا الصلبة إلى حوالي 300 درجة مئوية لإنتاج K3PO4.
هناك طريقة أخرى وهي تفاعل KH2PO4 مع KOH عند درجة حرارة عالية (أعلى من 400 درجة مئوية) لإنتاج K3PO4 والماء. ويمكن لفرن متخصص أن يقوم بهذه العملية التي تسمى بالتحلل الحراري.
يعتبر تفاعل حمض الفوسفوريك مع كربونات البوتاسيوم (K2CO3) وتفاعل أكسيد البوتاسيوم (K2O) مع خامس أكسيد الفوسفور (P2O5) من الطرق الإضافية لإنتاج K3PO4.
استخدامات فوسفات البوتاسيوم
لدى K3PO4 العديد من الاستخدامات العملية في مجموعة من الصناعات، بما في ذلك:
- الأسمدة: تستخدم عادة كسماد بسبب محتواها العالي من الفوسفور. غالبًا ما يضيفه المزارعون إلى التربة لتوفير العناصر الغذائية الأساسية للنباتات.
- صناعة الأغذية: يستخدم كمضاف غذائي لتنظيم مستويات الحموضة ومنع تغير اللون وتحسين الملمس.
- عامل التخزين المؤقت: تستخدمه العديد من التطبيقات المخبرية كعامل منظم فعال، بما في ذلك المحاليل المنظمة لمعايرة الرقم الهيدروجيني والأبحاث البيولوجية.
- المنظفات: تستخدم في صناعة المنظفات ومنتجات التنظيف نظراً لقدرتها على تليين الماء ومنع تراكم الرواسب المعدنية.
- الدواء: يستخدم كمكمل غذائي لعلاج بعض الحالات الطبية، مثل انخفاض مستويات الفوسفات في الدم.
- معالجة المياه: تستخدم في معالجة المياه لمنع تكون الترسبات والتآكل في الأنابيب والمعدات.
- مثبطات اللهب: تستخدم كمثبطات للهب في مواد مختلفة، بما في ذلك المنسوجات والبلاستيك، وذلك لقدرتها على إطلاق بخار الماء ومنع انتشار اللهب.
أسئلة:
س: هل فوسفات البوتاسيوم قابل للذوبان في الماء؟
ج: نعم، K3PO4 قابل للذوبان في الماء.
س: ما عدد أيونات البوتاسيوم اللازمة للارتباط بأيون الفوسفات؟
ج: يلزم وجود ثلاثة أيونات بوتاسيوم للارتباط بأيون الفوسفات لتكوين K3PO4.
س: ما هو الراسب الذي يتشكل عند خلط المحاليل المائية لبروميد الكالسيوم وفوسفات البوتاسيوم؟
ج: عند خلط المحاليل المائية لبروميد الكالسيوم مع K3PO4، يتكون راسب فوسفات الكالسيوم (Ca3(PO4)2).
س: هل k3po4 قابل للذوبان في الماء؟
ج: نعم، K3PO4 قابل للذوبان في الماء.
س: هل k3po4 قابل للذوبان؟
ج: نعم، K3PO4 قابل للذوبان في الماء.
س: ما هي المنتجات الناتجة عن خلط المحاليل المائية لـ Ni(C2H3O2)2 (aq) وK3PO4 (aq)؟
ج: عند خلط المحاليل المائية Ni(C2H3O2)2 وK3PO4، يتكون راسب من فوسفات النيكل (II) (Ni3(PO4)2)، كما تتشكل المحاليل المائية من أسيتات البوتاسيوم (KCH3COO) وحمض الأسيتيك (CH3COOH).
س: ما هو العنصر الذي يزيد عدد تأكسده في هذا التفاعل؟ 3KOH + H3PO4 → K3PO4 + 3H2O
ج: يزيد عنصر الفسفور عدد تأكسده من +5 في H3PO4 إلى +5 في K3PO4.
س: ما هو K3PO4؟
ج: K3PO4 هي الصيغة الكيميائية لفوسفات البوتاسيوم، وهو مركب يستخدم في تطبيقات مختلفة، مثل الأسمدة والمضافات الغذائية ومنتجات التنظيف.
