أسيتات الإيثيل سائل عديم اللون ذو رائحة فاكهية. يستخدم عادة كمذيب في مختلف الصناعات بما في ذلك الأدوية ومستحضرات التجميل والمواد الغذائية. أسيتات الإيثيل شديدة الاشتعال ويجب التعامل معها بحذر.
| اسم الأيوباك | إيثيل الأسيتات |
| الصيغة الجزيئية | C4H8O2 |
| CAS رقم | 141-78-6 |
| المرادفات | إستر إيثيل حمض الأسيتيك، إيثيل إيثانوات، أسيتوكسيثان، أسيتيدين، أسيتات الإيثيل، إستر إيثيل أسيتيك |
| إنتشي | إنتشي = 1S/C4H8O2/c1-3-6-4(2)5/h3H2.1-2H3 |
خصائص خلات الإيثيل
كثافة خلات الإيثيل جم / مل
تبلغ كثافة إيثيل إيثانوات 0.902 جم / مل في ظل الظروف القياسية لدرجة الحرارة والضغط. تشير هذه الكثافة إلى أن إيثانوات الإيثيل أقل كثافة من الماء وسوف يطفو فوقه. هذه الخاصية تجعلها مفيدة لفصل المخاليط السائلة من خلال عملية استخلاص سائل-سائل.
هيكل خلات الإيثيل
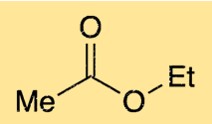
يتكون هيكل إيثيل إيثانوات من سلسلة رباعية الكربون مع مجموعة وظيفية إستر. تتكون المجموعة الوظيفية للإستر من ذرة أكسجين مرتبطة بذرة كربون، والتي بدورها ترتبط بذرة أكسجين أخرى. ترتبط ذرة الأكسجين الموجودة في مجموعة الإستر أيضًا بإحدى ذرات الكربون في السلسلة رباعية الكربون. يعطي هذا الهيكل إيثانوات الإيثيل رائحة الفواكه المميزة.
الكتلة المولية من خلات الإيثيل
الكتلة المولية لأسيتات الإيثيل هي 88.11 جم / مول. ويتم تحديده عن طريق إضافة الأوزان الذرية لجميع الذرات الموجودة في جزيء خلات الإيثيل. الصيغة الجزيئية لخلات الإيثيل هي C4H8O2، مما يشير إلى وجود 4 ذرات كربون، و8 ذرات هيدروجين، وذرتين أكسجين في كل جزيء. يتم استخدام الكتلة المولية لخلات الإيثيل في العديد من الحسابات، مثل تحديد كمية المادة في عينة معينة أو كتلة المادة في حجم معين.
نقطة غليان خلات الإيثيل
نقطة غليان إيثيل إيثانوات هي 77.1 درجة مئوية (171.8 درجة فهرنهايت) عند الضغط القياسي. يتمتع إيثيل إيثانوات بنقطة غليان منخفضة نسبيًا، مما يجعله مفيدًا في العديد من التطبيقات الصناعية كمذيب للاستخلاص والتنقية والتنظيف. عند تسخينه إلى نقطة الغليان، يتبخر إيثانوات الإيثيل ويمكن جمعه كسائل نقي من خلال التكثيف.
نقطة انصهار خلات الإيثيل
نقطة انصهار إيثانوات الإيثيل هي -83.6 درجة مئوية (-118.5 درجة فهرنهايت). تعني نقطة الانصهار المنخفضة هذه أن إيثانوات الإيثيل عادة ما يتم العثور عليه في صورة سائلة وليس صلبة في درجة حرارة الغرفة. ومع ذلك، فإنه يمكن أن يتصلب في درجات حرارة منخفضة للغاية أو تحت الضغط. عادة ما يكون الشكل الصلب لإيثانوات الإيثيل عبارة عن مسحوق بلوري أبيض.
الوزن الجزيئي لـ أسيتات الإيثيل
الوزن الجزيئي لإيثيل إيثانوات هو 88.11 جم / مول. تمثل هذه القيمة كتلة مول واحد من جزيئات إيثيل إيثانوات. يُستخدم الوزن الجزيئي في العديد من الحسابات، مثل تحديد كمية المادة في عينة معينة أو كتلة المادة في حجم معين.
صيغة خلات الإيثيل
الصيغة الكيميائية لإيثيل إيثانوات هي C4H8O2. تمثل هذه الصيغة عدد ونوع الذرات التي تشكل جزيء إيثيل إيثانوات. يتم ترتيب ذرات الكربون الأربع في الصيغة في سلسلة، حيث ترتبط كل ذرة كربون بذرتين أخريين. ترتبط أيضًا اثنتين من ذرات الكربون بذرات الأكسجين في المجموعة الوظيفية للإستر. ترتبط كل من ذرتي الكربون المتبقيتين بثلاث ذرات هيدروجين.
| مظهر | سائل عديم اللون |
| جاذبية معينة | 0.902 جرام/سم3 |
| لون | عديم اللون |
| يشم | فاكهي، حلو |
| الكتلة المولية | 88.11 جرام/مول |
| كثافة | 0.902 جرام/سم3 |
| نقطة الانصهار | -83.6 درجة مئوية |
| نقطة الغليان | 77.1 درجة مئوية |
| نقطة فلاش | -4 درجة مئوية |
| الذوبان في الماء | 80 جم/لتر عند 20 درجة مئوية |
| الذوبان | قابل للذوبان في الكحول والأثير والأسيتون والكلوروفورم |
| ضغط البخار | 73.3 ملم زئبق عند 20 درجة مئوية |
| كثافة بخار | 3.04 |
| pKa | 4.76 |
| الرقم الهيدروجيني | حيادي |
إيثيل إيثانوات هو سائل عديم اللون يستخدم على نطاق واسع في مختلف التطبيقات الصناعية والمختبرية. ومع ذلك، فإنه يشكل بعض المخاطر المتعلقة بالسلامة والصحة التي يجب أخذها في الاعتبار لضمان التعامل والاستخدام الآمن. قد يؤدي التعرض لإيثانوات الإيثيل إلى تهيج العينين والجلد والجهاز التنفسي. ويمكن أيضا أن يسبب الصداع والدوخة والغثيان. إيثيل إيثانوات مادة قابلة للاشتعال وقد تسبب حرائق أو انفجارات إذا تعرضت للحرارة أو اللهب. من المهم تخزين ومعالجة إيثانوات الإيثيل في منطقة جيدة التهوية، بعيدًا عن مصادر الاشتعال. وفي حالة التعرض العرضي، ينبغي التماس العناية الطبية الفورية لمنع المزيد من الضرر. يجب استخدام احتياطات السلامة المناسبة ومعدات الحماية عند التعامل مع إيثيل إيثانوات لتقليل مخاطر الإصابة أو الضرر.
| رموز الخطر | شي، ف |
| وصف الأمان | تجنب ملامسة الجلد والعينين. الابتعاد عن مصادر الاشتعال. استخدام في منطقة جيدة التهوية. |
| معرفات | UN1173 |
| رمز النظام المنسق | 2915.31.00 |
| فئة الخطر | 3- السوائل القابلة للاشتعال |
| مجموعة التعبئة | جنرال الكتريك الثاني |
| تسمم | LD50 (عن طريق الفم، الفئران) – 2 جم / كجم |
طرق تصنيع خلات الإيثيل
هناك طريقتان رئيسيتان، الأسترة ونزع الهيدروجين، تعملان على تصنيع إيثانوات الإيثيل بشكل فعال في الصناعة ذات الإنتاجية العالية.
تتضمن طريقة الأسترة التفاعل بين الإيثانول وحمض الأسيتيك في وجود محفز حمض قوي، مثل حمض الكبريتيك. تقوم عملية التقطير بفصل إيثانوات الإيثيل والماء الناتج عن التفاعل، لإنتاج عوائد عالية من إيثانوات الإيثيل، والذي يستخدم بشكل شائع في الصناعة.
تشتمل طريقة نزع الهيدروجين على تفاعل الإيثانول وحمض الأسيتيك فوق محفز أكسيد النحاس (II) عند درجة حرارة عالية. يقوم المحفز بتعزيز نزع الهيدروجين من الإيثانول لإنتاج الإيثيلين، والذي يتفاعل بعد ذلك مع حمض الأسيتيك لتكوين إيثانوات الإيثيل. هذه الطريقة أقل شيوعًا من الأسترة وتتطلب عمومًا درجات حرارة أعلى وأوقات تفاعل أطول.
هناك طريقة أخرى لتصنيع إيثانوات الإيثيل تتضمن تفاعل الإيثانول مع أنهيدريد الخل. تؤدي هذه الطريقة إلى إنتاج إيثانوات الإيثيل وحمض الأسيتيك، اللذين يمكن فصلهما بالتقطير.
استخدامات خلات الإيثيل
إيثيل إيثانوات هو مركب كيميائي متعدد الاستخدامات يستخدم على نطاق واسع في مختلف التطبيقات الصناعية والاستهلاكية. بعض الاستخدامات الأكثر شيوعًا لإيثانوات الإيثيل هي:
- المذيب: يستخدمه المصنعون كمذيب قوي في الدهانات والطلاءات والمواد اللاصقة.
- عامل النكهة: يستخدم كمادة منكهة في صناعة الأغذية والمشروبات، وخاصة في إنتاج المشروبات بنكهة الفواكه.
- العطر: عنصر شائع في العطور والكولونيا ومنتجات العناية الشخصية الأخرى بسبب رائحته الفاكهية اللطيفة.
- استخلاص الزيوت العطرية: يستخدم في استخلاص الزيوت العطرية من النباتات والزهور.
- المستحضرات الصيدلانية: يستخدم كمذيب في إنتاج الأدوية، وخاصة في صناعة المضادات الحيوية.
- عامل التنظيف: يستخدم لتنظيف الأجهزة الإلكترونية والمنسوجات والمواد الأخرى.
- الجلود الاصطناعية: يقوم مصنعو الجلود الاصطناعية بتنعيم المادة وجعلها أكثر مرونة باستخدام أسيتات الإيثيل كمادة ملدنة.
- وسيط كيميائي: يقوم منتجو المواد الكيميائية بإنتاج مواد كيميائية أخرى، مثل خلات السليلوز، وخلات الفينيل، وأكريليت الإيثيل، باستخدام إيثانوات الإيثيل كمادة كيميائية وسيطة.
أسئلة:
س: هل خلات الإيثيل قطبية أم غير قطبية؟
ج: إيثيل إيثانوات هو مذيب قطبي بسبب وجود مجموعة الكربونيل (C=O) وذرة الأكسجين في تركيبه الجزيئي. ومع ذلك، فهو ليس قطبيًا مثل المذيبات الأخرى مثل الماء أو الإيثانول.
س: هل خلات الإيثيل قابلة للامتزاج بالماء؟
ج: إيثانوات الإيثيل غير قابل للامتزاج مع الماء، أي أنه لا يمتزج جيداً مع الماء. ويرجع ذلك إلى اختلاف القطبية بين المادتين، حيث أن الماء مذيب عالي القطبية وإيثانوات الإيثيل مذيب أقل قطبية.
س: هل خلات الإيثيل قابلة للذوبان في الماء؟
ج: إيثيل إيثانوات قابل للذوبان بشكل طفيف في الماء، مع قابلية ذوبان تبلغ حوالي 8٪ في درجة حرارة الغرفة. ومع ذلك، فإن قابلية الذوبان هذه محدودة بسبب اختلاف القطبية بين المادتين. إيثيل إيثانوات أكثر قابلية للذوبان في المذيبات غير القطبية مثل الهكسان أو التولوين.
