يتشكل حمض الكربونيك (H2CO3) عندما يذوب ثاني أكسيد الكربون في الماء ويلعب دورًا حاسمًا في تنظيم درجة حموضة المحيطات والتحكم في التجوية الصخرية.
| اسم الأيوباك | حمض الكربونيك |
| الصيغة الجزيئية | H2CO3 |
| CAS رقم | 463-79-6 |
| المرادفات | الهواء الحامض الهواء الحامض H2CO3؛ أوكسيدانيوميليدينيميثان. كربونات حمضية هيدروكسي كيتون. ثنائي هيدروكسي ميثانون |
| إنتشي | InChI=1S/CH2O3/c2-1(3)4/ساعة(H2,2,3,4) |
صيغة حمض الكربونيك
الصيغة الكيميائية لحمض الكربونيك هي H2CO3، مما يدل على أنه يتكون من ذرتي هيدروجين، وذرة كربون واحدة، وثلاث ذرات أكسجين. توضح الصيغة أيضًا نسبة الذرات في الجزيء، وهو أمر مهم لتحديد قياس العناصر الكيميائية للتفاعلات الكيميائية التي تتضمن حمض الكربونيك.
الكتلة المولية لحمض الكربونيك
تبلغ الكتلة المولية لحمض الكربونيك حوالي 62.03 جم / مول. وهو حمض ضعيف يتشكل عندما يذوب ثاني أكسيد الكربون في الماء وهو مسؤول عن تنظيم الرقم الهيدروجيني للمحيطات. تعتبر الكتلة المولية لحمض الكربونيك مهمة لحساب كمية الحمض اللازمة للوصول إلى درجة حموضة معينة في المحلول ولتحديد كمية ثاني أكسيد الكربون التي يمكن أن تذوب في الماء.
نقطة غليان حمض الكربونيك
ليس لحمض الكربونيك نقطة غليان محددة جيدًا، لأنه يتحلل إلى الماء وثاني أكسيد الكربون قبل أن يصل إلى نقطة الغليان. ومع ذلك، عند الضغط الجوي، يتحلل حمض الكربونيك عند درجة حرارة حوالي 333 كلفن (60 درجة مئوية) إلى الماء وثاني أكسيد الكربون.
نقطة انصهار حمض الكربونيك
حمض الكربونيك ليس لديه نقطة انصهار محددة بشكل جيد، لأنه يتحلل إلى الماء وثاني أكسيد الكربون قبل أن يصل إلى نقطة انصهاره. ومع ذلك، عند الضغط الجوي، يتحلل حمض الكربونيك عند درجة حرارة حوالي 273 كلفن (-0.15 درجة مئوية) إلى الماء وثاني أكسيد الكربون.
كثافة حمض الكربونيك جم/مل
تبلغ كثافة حمض الكربونيك حوالي 1.67 جم / مل عند درجة حرارة الغرفة (25 درجة مئوية). يمكن أن تختلف هذه القيمة اعتمادًا على تركيز المحلول، وكذلك درجة الحرارة والضغط البيئي.
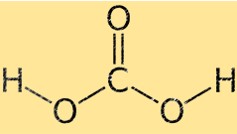
هيكل حمض الكربونيك
يمتلك حمض الكربونيك هندسة جزيئية رباعية السطوح، حيث توجد ذرة الكربون في المركز والذرات الأربع المحيطة (اثنتان من الأكسجين واثنين من الهيدروجين) تقع في زوايا رباعي السطوح. ترتبط ذرتا الأكسجين بذرة الكربون بروابط مزدوجة، بينما ترتبط ذرتا الهيدروجين بروابط فردية.
الوزن الجزيئي لحمض الكربونيك
الوزن الجزيئي لحمض الكربونيك هو 62.03 جم / مول. ويتم حساب هذه القيمة عن طريق جمع الأوزان الذرية للعناصر المكونة لها، وهي الهيدروجين (H)، والكربون (C)، والأكسجين (O).
| مظهر | سائل عديم اللون أو صلب بلوري |
| جاذبية معينة | 1.67 جرام/سم3 |
| لون | عديم اللون |
| يشم | عديم الرائحة |
| الكتلة المولية | 62.03 جم/مول |
| كثافة | 1.67 جم/مل في درجة حرارة الغرفة (25 درجة مئوية) |
| نقطة الانصهار | يتحلل عند درجة حرارة 273 كلفن تقريبًا (-0.15 درجة مئوية) |
| نقطة الغليان | يتحلل عند درجة حرارة 333 كلفن تقريبًا (60 درجة مئوية) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان تماما |
| الذوبان | قابل للذوبان في الماء والإيثانول والميثانول |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | 3.6 (التفكك الأول) |
| الرقم الهيدروجيني | 5.6 (في محلول 0.1 متر) |
حمض الكربونيك السلامة والمخاطر
يعتبر حمض الكربونيك (H2CO3) آمنًا بشكل عام، لكنه قد يشكل بعض المخاطر في مواقف معينة. التعرض لـ H2CO3 يمكن أن يسبب تهيج العينين والجلد والجهاز التنفسي ويؤدي إلى السعال والصفير وضيق التنفس. تناول H2CO3 يمكن أن يسبب اضطراب في المعدة والغثيان والقيء. يعتبر H2CO3 أيضًا حمضًا ضعيفًا ويمكن أن يتفاعل مع معادن معينة، مثل الألومنيوم والزنك، لإنتاج غاز الهيدروجين القابل للاشتعال. عند التعامل مع أو استخدام H2CO3، ينبغي اتخاذ احتياطات السلامة المناسبة، بما في ذلك ارتداء الملابس الواقية والتهوية الكافية. في حالة التعرض لها، ينبغي طلب الرعاية الطبية على الفور.
| رموز الخطر | لا أحد |
| وصف الأمان | غير سام |
| أرقام تعريف الأمم المتحدة | أ 1824 |
| رمز النظام المنسق | 28111990 |
| فئة الخطر | 8- المواد المسببة للتآكل |
| مجموعة التعبئة | ثالثا |
| تسمم | سمية منخفضة |
طرق تصنيع حمض الكربونيك
يمكن تصنيع H2CO3 بطرق مختلفة. إحدى الطرق الشائعة هي تفاعل ثاني أكسيد الكربون (CO2) مع الماء (H2O) في وجود محفز. تنتج هذه العملية، التي تسمى الترطيب، حمض الكربونيك:
CO2 + H2O → H2CO3
هناك طريقة أخرى لتصنيع حمض الكربونيك تتضمن تفاعل كربونات الكالسيوم (CaCO3) مع حمض، مثل حمض الهيدروكلوريك (HCl). تنتج هذه العملية، التي تسمى التحمض، حمض الكربونيك:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
التفاعل بين حمض الأكساليك والكربونات، مثل كربونات الصوديوم (Na2CO3)، يسمح بتخليق حمض الكربونيك. تنتج هذه العملية حمض الكربونيك والملح، مثل أكسالات الصوديوم:
H2C2O4 + Na2CO3 → 2H2CO3 + Na2C2O4
تنتج عملية سولفاي حمض الكربونيك وبيكربونات الصوديوم عن طريق تفاعل كربونات الصوديوم (Na2CO3) مع ثاني أكسيد الكربون في وجود الماء.
2NaHCO3 + CO2 → Na2CO3 + H2CO3
بشكل عام، هناك عدة طرق متاحة لتخليق حمض الكربونيك، ولكل منها مزاياها وقيودها. يعتمد اختيار الطريقة على عوامل مثل النقاء المطلوب للمنتج وتوافر المواد الخام وحجم الإنتاج المطلوب.
استخدامات حمض الكربونيك
حمض الكربونيك (H2CO3) هو مركب متعدد الاستخدامات يجد العديد من الاستخدامات في الصناعة والطب والحياة اليومية. بعض الاستخدامات الرئيسية لـ H2CO3 تشمل:
- المشروبات الغازية: H2CO3 هو المركب المسؤول عن الفوران المميز في المشروبات الغازية مثل الصودا والبيرة.
- يقوم H2CO3 بتخزين الرقم الهيدروجيني في العمليات الصناعية المختلفة، مثل معالجة المياه وتجهيز الأغذية.
- إنه يطفئ النار عن طريق إزاحة الأكسجين ومنع الاحتراق.
- يمنع H2CO3 نمو البكتيريا والعفن في أنواع معينة من المنتجات الغذائية للحفاظ عليها.
- يعمل كعامل تنظيف لطيف، خاصة لإزالة الرواسب المعدنية.
- يستخدم متخصصو الرعاية الصحية H2CO3 في بعض التطبيقات، بما في ذلك علاج بعض الآفات الجلدية والحث على انقباض الشعب الهوائية أثناء اختبارات وظائف الرئة.
- يستخدم عمال اللحام H2CO3 كغاز وقائي لمنع الأكسدة وإنتاج لحامات أنظف.
بشكل عام، يعد حمض الكربونيك مركبًا مفيدًا ومتعدد الاستخدامات وله نطاق واسع من التطبيقات في مختلف المجالات.
أسئلة:
س: هل حمض الكربونيك حمض قوي؟
ج: حمض الكربونيك هو حمض ضعيف، أي أنه يتفكك جزئيًا فقط في الماء لينتج أيونات الهيدروجين (H+) وأيونات البيكربونات (HCO3-). ثابت تفككه الحمضي (Ka) منخفض نسبيًا، مما يشير إلى أنه لا يتفكك تمامًا في الماء.
س: هل ثاني أكسيد الكربون حمضي؟
ج: ثاني أكسيد الكربون (CO2) ليس حمضيًا بطبيعته، فهو مركب متعادل لا ينتج أيونات الهيدروجين (H+) في الماء. ومع ذلك، عندما يذوب ثاني أكسيد الكربون في الماء، فإنه يمكن أن يتفاعل مع جزيئات الماء لتكوين حمض الكربونيك، وهو حمض ضعيف. يمكن أن يؤدي هذا التفاعل إلى انخفاض الرقم الهيدروجيني، مما يجعل المحلول أكثر حمضية. لذلك، على الرغم من أن ثاني أكسيد الكربون في حد ذاته ليس حمضيًا، إلا أنه يمكن أن يساهم في حموضة المحلول عندما يتفاعل مع الماء.
