ثيوكبريتات الصوديوم مركب كيميائي له الصيغة Na2S2O3. ويشيع استخدامه كمثبت في معالجة الصور الفوتوغرافية وكعامل اختزال في بعض التفاعلات الكيميائية.
| اسم الأيوباك | ثيوكبريتات الصوديوم |
| الصيغة الجزيئية | Na2S2O3 |
| CAS رقم | 7772-98-7 |
| المرادفات | هيبوسلفيت الصوديوم، ثيوكبريتات الصوديوم، ملح ثنائي الصوديوم من حمض ثيوكبريتيك، ثيوكبريتات الصوديوم بنتاهيدرات |
| إنتشي | InChI=1S/2Na.H2O3S2/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
خصائص ثيوكبريتات الصوديوم
صيغة ثيوكبريتات الصوديوم
الصيغة الكيميائية لثيوكبريتات الصوديوم هي Na2S2O3. ويتكون من أيونين Na+ وأيونات S2O32-. توضح الصيغة أنواع وعدد الذرات الموجودة في جزيء المركب.
ثيوكبريتات الصوديوم الكتلة المولية
الكتلة المولية لـ Na2S2O3 هي 158.11 جم/مول. ويتم حسابه عن طريق جمع الكتل الذرية لجميع الذرات الموجودة في مول واحد من المركب. هذه القيمة مفيدة لتحديد كمية Na2S2O3 اللازمة لتفاعل معين أو لحساب تركيز المحلول.
نقطة غليان ثيوكبريتات الصوديوم
Na2S2O3 ليس له نقطة غليان لأنه يتحلل قبل أن يصل إلى نقطة الغليان. عند الضغط الطبيعي، يتحلل بين 48 و55 درجة مئوية، ويطلق ثاني أكسيد الكبريت. هذه الخاصية تجعلها غير مناسبة لتطبيقات درجات الحرارة المرتفعة.
نقطة انصهار ثيوكبريتات الصوديوم
نقطة انصهار Na2S2O3 هي 48.3 درجة مئوية. هذه هي درجة الحرارة التي يتحول عندها المركب الصلب إلى سائل. نقطة انصهاره منخفضة نسبياً مقارنة بالأملاح غير العضوية الأخرى، مما يجعل من السهل ذوبانه في الماء.
كثافة ثيوكبريتات الصوديوم جم/مل
تبلغ كثافة Na2S2O3 1.667 جم/مل. تشير هذه القيمة إلى كتلة المادة لكل وحدة حجم. وهي أكبر من كثافة الماء، مما يعني أن Na2S2O3 يغوص في الماء.
الوزن الجزيئي لثيوكبريتات الصوديوم
الوزن الجزيئي لـ Na2S2O3 هو 158.11 جم / مول. وهو مجموع الأوزان الذرية لجميع الذرات الموجودة في جزيء المركب. الوزن الجزيئي مفيد لتحديد كمية Na2S2O3 اللازمة لتفاعل معين أو لحساب تركيز المحلول.
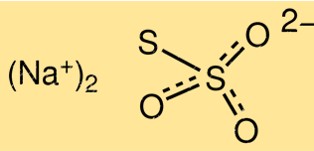
هيكل ثيوكبريتات الصوديوم
يتكون هيكل Na2S2O3 من أيونين S2O3 2- مرتبطين بأيون الصوديوم Na+. يحتوي الجزيء على شكل هرم ثلاثي بزاوية رابطة تبلغ حوالي 103 درجة. يحتوي أيون الثيوكبريتات على رابطة واحدة بين الكبريت والكبريت ورابطتين بين الكبريت والأكسجين.
ذوبان ثيوكبريتات الصوديوم
Na2S2O3 قابل للذوبان بشدة في الماء. تزداد قابلية ذوبان Na2S2O3 في الماء مع زيادة درجة الحرارة، حيث يذوب حوالي 70 جم من المركب في 100 مل من الماء عند درجة حرارة 25 درجة مئوية. كما أنه قابل للذوبان في الجلسرين وقابل للذوبان بشكل طفيف في الكحول. قابليته للذوبان تجعله مفيدًا في العديد من التطبيقات، مثل معالجة الصور الفوتوغرافية والعلاجات الطبية.
| مظهر | مسحوق بلوري أبيض |
| جاذبية معينة | 1,667 جم/مل |
| لون | عديم اللون إلى الأبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 158.11 جرام/مول |
| كثافة | 1,667 جم/مل |
| نقطة الانصهار | 48.3 درجة مئوية |
| نقطة الغليان | ينهار قبل الغليان |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان للغاية |
| الذوبان | قابل للذوبان في الجلسرين وقابل للذوبان بشكل طفيف في الكحول |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | محايد (الرقم الهيدروجيني 7) |
سلامة ومخاطر ثيوكبريتات الصوديوم
يعتبر Na2S2O3 آمنًا بشكل عام عند التعامل معه بشكل صحيح. ومع ذلك، يمكن أن يكون ضارًا إذا تم تناوله أو استنشاقه أو ملامسته للعين أو الجلد. قد يسبب المركب تهيج الجلد والعين، وقد يؤدي التعرض لفترة طويلة إلى التهاب الجلد. قد يؤدي تناول Na2S2O3 إلى حدوث اضطرابات في الجهاز الهضمي، مثل الغثيان والقيء. ومن المهم ارتداء معدات الحماية الشخصية المناسبة، مثل القفازات ونظارات السلامة، عند العمل مع Na2S2O3. وفي حالة التعرض لها، يجب غسل المنطقة المصابة بالماء وطلب العناية الطبية إذا لزم الأمر.
| رموز الخطر | لا أحد |
| وصف الأمان | تجنب ملامسة العينين والجلد، والملابس. لا يبتلع. ارتداء معدات الحماية الشخصية المناسبة. |
| أرقام تعريف الأمم المتحدة | UN3077 |
| رمز النظام المنسق | 2832.3010.00 |
| فئة الخطر | 9 |
| مجموعة التعبئة | ثالثا |
| تسمم | سمية منخفضة. الجرعة المميتة 50 (عن طريق الفم، الفئران) هي 6200 ملغم/كغم |
طرق تخليق ثيوكبريتات الصوديوم
يمكن لطرق مختلفة تصنيع Na2S2O3.
الطريقة الشائعة هي تفاعل كبريتيت الصوديوم مع الكبريت في وجود محلول قلوي. تتضمن الطريقة الأخرى تفاعل كبريتيت الصوديوم مع ثاني أكسيد الكبريت تحت الضغط.
إحدى طرق تحضير Na2S2O3 هي إذابة الكبريت في محلول ساخن من كبريتيت الصوديوم وهيدروكسيد الصوديوم . يبرد المحلول ويقوم شخص ما بتصفيته للحصول على منتج صلب.
في هذه الطريقة، يتم تفاعل ثاني أكسيد الكبريت مع هيدروكسيد الصوديوم لإنتاج كبريتيت الصوديوم، ومن ثم يتفاعل مع عنصر الكبريت لإنتاج Na2S2O3.
لإنتاج Na2S2O3، يمكن تفاعل حمض الكبريتيك مع كبريتيت الصوديوم، ثم تسخين المحلول الناتج وإضافة الكبريت. سوف يتفاعل بعد ذلك كبريتيت الصوديوم مع الكبريت لتكوين Na2S2O3.
تتضمن الطريقة الأخرى تفاعل هيدروكسيد الصوديوم مع الكبريت، ثم إضافة كبريتيت الصوديوم لتكوين Na2S2O3.
استخدامات ثيوكبريتات الصوديوم
Na2S2O3 لديه مجموعة واسعة من الاستخدامات في مختلف الصناعات والتطبيقات، بما في ذلك:
- التصوير الفوتوغرافي: يستخدم كعامل تثبيت لإزالة هاليد الفضة غير المكشوف من المطبوعات الفوتوغرافية والأفلام.
- معالجة المياه: تستخدم لإزالة الكلور من المياه عن طريق تحييد الكلور ومنع آثاره الضارة على الحياة المائية.
- التطبيقات الطبية: يستخدم في علاج التسمم بالسيانيد لأنه يتفاعل مع السيانيد لتكوين الثيوسيانات وهو أقل سمية ويمكن إخراجه من الجسم.
- التطبيقات الصناعية: يستخدم كعامل اختزال في العمليات الكيميائية وكمادة حافظة في المنسوجات والجلود والورق.
- الكيمياء التحليلية: تستخدم كمحلول معاير في تحليل المعادن المختلفة مثل النحاس والزرنيخ.
- صناعة الأغذية والمشروبات: تستخدم كمادة حافظة للأغذية لمنع تغير اللون وكمحسن للنكهة.
- البستنة: يستخدم لتحييد آثار الكلور في المياه المستخدمة لري النباتات.
أسئلة:
س: ما هو ثيوكبريتات الصوديوم المستخدمة؟
ج: يحتوي Na2S2O3 على مجموعة واسعة من التطبيقات، بما في ذلك التصوير الفوتوغرافي ومعالجة المياه والعلاجات الطبية والعمليات الصناعية والكيمياء التحليلية وحفظ الأطعمة والمشروبات والبستنة.
س: كيفية صنع ثيوكبريتات الصوديوم؟
ج: يمكن تحضير Na2S2O3 عن طريق تفاعل كبريتيت الصوديوم مع الكبريت أو ثاني أكسيد الكبريت في وجود محلول قلوي. تتضمن الطرق الأخرى تفاعل هيدروكسيد الصوديوم مع الكبريت أو ثاني أكسيد الكبريت لإنتاج كبريتيت الصوديوم، والذي يتفاعل بعد ذلك مع الكبريت لإنتاج Na2S2O3.
س: ما هو ثيوكبريتات الذهب الصوديوم؟
ج: الذهب Na2S2O3 هو مركب معقد يتكون من تفاعل كلوريد الذهب مع Na2S2O3. يتم استخدامه في طلاء الذهب والكيمياء التحليلية للكشف عن الذهب وقياسه.
س: أين يمكن شراء ثيوكبريتات الصوديوم؟
ج: يمكن شراء Na2S2O3 من موردي المواد الكيميائية وشركات توريد المختبرات وتجار التجزئة عبر الإنترنت.
س: أين يمكنني أن أجد ثيوكبريتات الصوديوم؟
ج: يمكن العثور على Na2S2O3 في مجموعة متنوعة من المنتجات، بما في ذلك المواد الكيميائية الفوتوغرافية ومنتجات معالجة المياه والعلاجات الطبية.
س: ما هو عدد تأكسد الكبريت في Na2S2O3 ؟
ج: عدد أكسدة الكبريت في Na2S2O3 هو +2 في أيون الثيوكبريتات (S2O3^2-) و+6 في أيون الكبريتات (SO4^2-).
س: كيف يمكن العثور على وزن النحاس من معايرة Na2S2O3؟
ج: يمكن حساب وزن النحاس من حجم ومولارية محلول Na2S2O3 المستخدم في المعايرة، باستخدام المعادلة الكيميائية المتوازنة للتفاعل بين Cu وNa2S2O3.
س: كيف ستعرف أنه تمت إضافة كمية متكافئة من Na2S2O3؟
ج: تمت إضافة كمية متكافئة من Na2S2O3 عند الوصول إلى نقطة نهاية التفاعل، كما يتضح من التغير في اللون أو أي خاصية فيزيائية أو كيميائية أخرى.
س: إذا تمت إضافة 5 قطرات من 0.15 M KI إلى 40 قطرة من Na2S2O3، فما هو التركيز النهائي لـ KI؟
ج: لا يمكن تحديد التركيز النهائي لـ KI بدون معلومات إضافية، مثل حجم أو تركيز محلول Na2S2O3.
س: كيف تجد مولارية Na2S2O3؟
ج: يمكن حساب مولارية Na2S2O3 من كتلة العينة وحجم وتركيز المحلول المستخدم لإذابتها، وذلك باستخدام الصيغة المولارية = عدد مولات المذاب/حجم المحلول باللتر.
