ثيوكبريتات الصوديوم خماسي هيدرات (Na2S2O3 · 5H2O) هو مركب بلوري يذوب بسهولة في الماء. ويشيع استخدامه في معالجة الصور الفوتوغرافية وكترياق طبي للتسمم بالسيانيد.
| اسم الأيوباك | ثيوسلفات الصوديوم خماسي هيدرات |
| الصيغة الجزيئية | Na2S2O3 · 5H2O |
| CAS رقم | 10102-17-7 |
| المرادفات | هيبوكبريتيت الصوديوم خماسي هيدرات، ثيوكبريتات الصوديوم خماسي هيدرات، ثيوسلفات الصوديوم هيدرات، ثيوكبريتات الصوديوم 5-هيدرات |
| إنتشي | InChI=1S/2Na.H2O3S2.5H2O/c;;1-5(2,3)4;;;;;/h;;(H2,1,2,3,4);5 1H2/q2 +1; ;;;;;/ص-2 |
خصائص ثيوكبريتات الصوديوم بنتاهيدرات
صيغة ثيوكبريتات الصوديوم بنتاهيدرات
الصيغة الكيميائية لخماسي ثيوكبريتات الصوديوم هي Na2S2O3 · 5H2O. ويتكون من أيونين Na+ وأيونات (S2O3)2- وخمسة جزيئات ماء. يتمتع المركب بمظهر بلوري أبيض وقابل للذوبان بدرجة عالية في الماء.
ثيوكبريتات الصوديوم خماسي هيدرات الكتلة المولية
الكتلة المولية لـ Na2S2O3 · 5H2O هي 248.18 جم/مول. وهو مجموع الكتل الذرية للصوديوم والكبريت والأكسجين والهيدروجين الموجودة في المركب. الكتلة المولية هي معلمة مهمة في الحسابات الكيميائية، وخاصة لتحديد كمية المادة اللازمة للتفاعل.
نقطة غليان ثيوكبريتات الصوديوم بنتاهيدرات
Na2S2O3 · 5H2O ليس له نقطة غليان محددة لأنه يتحلل عند تسخينه. وبدلا من ذلك، فإنه يخضع لعملية تحلل حراري ينتج عنها إطلاق بخار الماء وثاني أكسيد الكبريت. تبلغ درجة حرارة تحلل Na2S2O3 · 5H2O حوالي 48 درجة مئوية.
ثيوكبريتات الصوديوم بنتاهيدرات نقطة الانصهار
درجة انصهار Na2S2O3 · 5H2O هي 48.3 درجة مئوية. عند درجة الحرارة هذه، يخضع المركب لتغير طوري من الحالة الصلبة إلى الحالة السائلة. Na2S2O3 · 5H2O له نقطة انصهار منخفضة نسبيًا، ويعزى ذلك إلى وجود جزيئات الماء في تركيبته البلورية.
كثافة ثيوكبريتات الصوديوم خماسي الهيدرات جم/مل
تبلغ كثافة Na2S2O3 · 5H2O 1.67 جم/مل. يتمتع المركب بكثافة عالية نسبياً مقارنة بالأملاح الأخرى، وذلك بسبب وجود عدة أيونات في بنيته البلورية. يتم تعريف كثافة المادة على أنها مقدار الكتلة لكل وحدة حجم.
ثيوكبريتات الصوديوم بينتاهيدرات الوزن الجزيئي
الوزن الجزيئي لـ Na2S2O3 · 5H2O هو 248.18 جم/مول. وهو مجموع الأوزان الذرية للعناصر الموجودة في المركب. الوزن الجزيئي هو عامل مهم في الحسابات الكيميائية، وخاصة لتحديد قياس العناصر الكيميائية للتفاعل.
هيكل خماسي الهيدرات من ثيوكبريتات الصوديوم
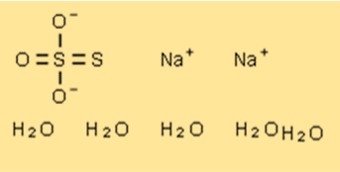
يتكون التركيب البلوري لـ Na2S2O3 · 5H2O من كاتيونات الصوديوم وأنيونات الثيوسلفات وجزيئات الماء. توجد أيونات الصوديوم في زوايا خلية الوحدة، في حين يتم ترتيب أنيونات الثيوسلفات وجزيئات الماء في هيكل متعدد الطبقات. تشكل أنيونات الثيوكبريتات وجزيئات الماء سلاسل تمتد على طول المحور c لخلية الوحدة.
ذوبان ثيوكبريتات الصوديوم بنتاهيدرات
Na2S2O3 · 5H2O شديد الذوبان في الماء. يتم تعريف قابلية ذوبان المادة على أنها الحد الأقصى لكمية المادة التي يمكن إذابتها في كمية معينة من المذيب عند درجة حرارة وضغط محددين. تزداد قابلية ذوبان Na2S2O3 · 5H2O في الماء مع ارتفاع درجة الحرارة ويستخدم في مختلف التطبيقات الصناعية والطبية.
| مظهر | مادة صلبة بلورية بيضاء |
| جاذبية معينة | 1.67 جم/مل |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 248.18 جرام/مول |
| كثافة | 1.67 جم/مل |
| نقطة الانصهار | 48.3 درجة مئوية |
| نقطة الغليان | يتحلل عند 48 درجة مئوية |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان للغاية |
| الذوبان | قابل للذوبان في الماء والجلسرين |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | 7.2 |
| الرقم الهيدروجيني | 6.5-9.5 (5% محلول في الماء) |
ثيوكبريتات الصوديوم بنتاهيدرات السلامة والمخاطر
يعتبر Na2S2O3 · 5H2O آمنًا بشكل عام في التعامل معه واستخدامه. ومع ذلك، فإنه يمكن أن يسبب تهيج العينين والجلد والجهاز التنفسي. قد يؤدي تناول كميات كبيرة من Na2S2O3 · 5H2O إلى حدوث اضطراب في الجهاز الهضمي. ومن المهم أيضًا تجنب ملامسة العوامل المؤكسدة والأحماض القوية، لأنها قد تتفاعل بعنف مع هذه المواد. Na2S2O3 · 5H2O لا يعتبر خطراً للحريق أو الانفجار، ولكنه قد ينبعث منه أبخرة سامة عند تسخينه حتى يتحلل. كما هو الحال مع جميع المواد الكيميائية، ينبغي اتخاذ الاحتياطات المناسبة عند التعامل مع واستخدام Na2S2O3 · 5H2O لتقليل أي مخاطر محتملة.
| رموز الخطر | لا أحد |
| وصف الأمان | S24/25 – تجنب ملامسة الجلد والعينين |
| أرقام تعريف الأمم المتحدة | غير منتظم |
| رمز النظام المنسق | 2832.10.00 |
| فئة الخطر | غير مصنفة على أنها خطرة بموجب النظام المنسق عالمياً (GHS). |
| مجموعة التعبئة | غير قابل للتطبيق |
| تسمم | الجرعة المميتة 50 (عن طريق الفم، الفئران): > 6000 ملغم/كغم |
طرق تخليق ثيوكبريتات الصوديوم بنتاهيدرات
هناك طرق مختلفة يمكنها تصنيع Na2S2O3 · 5H2O.
تتضمن الطريقة الشائعة تفاعل كبريتيت الصوديوم مع الكبريت في الظروف القلوية. هناك طريقة أخرى تتضمن تفاعل هيدروكسيد الصوديوم مع ثاني أكسيد الكبريت، يليه إضافة الكبريت. عند تسخين الخليط ينتج Na2S2O3 · 5H2O.
لتصنيع Na2S2O3 · 5H2O، يتفاعل الكيميائيون مع كبريتيد الصوديوم وثاني أكسيد الكبريت، مما يؤدي إلى تكوين كبريتيت الصوديوم. ثم قم بأكسدة كبريتيت الصوديوم مع بيروكسيد الهيدروجين أو الكلور لتكوين كبريتات الصوديوم. يتم تفاعل الكبريت مع كبريتات الصوديوم تحت ظروف قلوية ويتم تسخين الخليط الناتج ليعطي Na2S2O3 · 5H2O.
ومن المهم ملاحظة أن تخليق Na2S2O3 · 5H2O يجب أن يتم مع احتياطات السلامة المناسبة، مثل استخدام معدات الحماية والتهوية الكافية. بالإضافة إلى ذلك، يمكن أن تؤثر نقاء المواد الخام وظروف التفاعل على إنتاجية ونقاء المنتج النهائي.
استخدامات ثيوكبريتات الصوديوم بنتاهيدرات
Na2S2O3 · 5H2O له استخدامات عديدة في صناعات مختلفة بسبب خصائصه الفريدة. بعض استخداماته الشائعة تشمل:
- التصوير الفوتوغرافي: يعمل بشكل فعال كمثبت للصور الفوتوغرافية لإزالة هاليد الفضة غير المكشوف من فيلم التصوير الفوتوغرافي.
- طبياً: يستخدم كمضاد للتسمم بالسيانيد لأنه يمكن أن يتفاعل مع السيانيد لتكوين الثيوسيانات الأقل سمية.
- معالجة المياه: يستخدم لإزالة الكلور من الماء وهو مهم في الصناعات مثل حمامات السباحة وأحواض السمك ومعالجة مياه الصرف الصحي.
- الكيمياء التحليلية: تستخدم كعامل اختزال في المعايرة وكعامل معقد في تقدير المعادن الثقيلة.
- الزراعة: يستخدم كسماد لتصحيح نقص الكبريت في النباتات.
- صناعة النسيج: يستخدم أيضاً كمبيض للأقمشة الصوفية والحريرية.
- تعدين الذهب: يستخدم في تعدين الذهب لاستخراج الذهب من الخامات عن طريق الترشيح.
- الاستخدامات الأخرى: يشيع استخدامه في إنتاج الورق وفي صناعة الأصباغ وككاشف مختبري.
أسئلة:
س: ما عدد جرامات ثيوكبريتات الصوديوم اللازمة لتحضير 250.0 مل من 0.1000 م؟
ج: لتحضير 250.0 مل من محلول 0.1000 م من Na2S2O3 · 5H2O، ستحتاج إلى 9.944 جرام من Na2S2O3 · 5H2O.
س: كيف يمكنني تخفيف ثيوكبريتات الصوديوم بنتاهيدرات؟
ج: يمكن تخفيف Na2S2O3 · 5H2O بإذابته في الماء. تعتمد كمية الماء المطلوبة على التركيز المطلوب للمحلول.
س: ما هو عدد جرامات ثيوكبريتات الصوديوم الصلبة اللازمة للتحضير بالضبط؟
ج: تعتمد كمية المادة الصلبة Na2S2O3 · 5H2O اللازمة لتحضير المحلول على التركيز المطلوب وحجم المحلول. يمكنك استخدام الصيغة C1V1 = C2V2، حيث C1 وV1 هما التركيز الأولي والحجم، على التوالي، وC2 وV2 هما التركيز والحجم النهائيان، على التوالي، لحساب كمية المادة الصلبة المطلوبة.
س: ما هو استخدام ثيوكبريتات الصوديوم بنتاهيدرات؟
ج: يستخدم Na2S2O3 · 5H2O في التصوير الفوتوغرافي والصناعة الطبية ومعالجة المياه والكيمياء التحليلية والزراعة وصناعة النسيج وتعدين الذهب وإنتاج الورق وتصنيع الأصباغ وككاشف مختبري.
س: من يبيع ثيوكبريتات الصوديوم بنتاهيدرات؟
ج: يتم بيع Na2S2O3 · 5H2O بواسطة العديد من موردي وموزعي المواد الكيميائية، سواء عبر الإنترنت أو خارجه. تتضمن بعض الأمثلة Sigma-Aldrich وFisher Scientific وVWR International.
س: ما الذي يمكنني استخدامه بدلاً من Na2S2O3·5H2O لإخماد أي تفاعلات؟
ج: هناك العديد من المركبات الكيميائية التي يمكن استخدامها كبديل لـ Na2S2O3 · 5H2O لتفاعلات التبريد، اعتمادًا على التفاعل والمتطلبات المحددة. وتشمل بعض الأمثلة اليوريا، وهيدروكلوريد الهيدروكسيلامين، وثنائي كبريتيت الصوديوم.
س: ما هو Na2S2O3·5H2O؟
ج: Na2S2O3·5H2O هي الصيغة الكيميائية لـ Na2S2O3·5H2O، وهو مركب بلوري أبيض يستخدم في مختلف التطبيقات الصناعية والمختبرية.
