بيروكسيد المغنيسيوم (MgO2) هو مركب يتكون من المغنيسيوم والأكسجين. يستخدم عادة في الزراعة كمصدر للأكسجين بطيء الإطلاق وكتعديل للتربة لتحسين نمو النبات.
| اسم الأيوباك | بيروكسيد المغنيسيوم |
| الصيغة الجزيئية | أكسيد المغنيسيوم 2 |
| CAS رقم | 14452-57-4 |
| المرادفات | ثاني أكسيد المغنيسيوم، المغنيسيوم. بيروكسيد، بيرماج، ماجيكز، أوكسي جين، إينكس 215-217-9 |
| إنتشي | InChI=1S/Mg.2O2/h;2*1H/q+2;;/p-2 |
خصائص بيروكسيد المغنيسيوم
صيغة بيروكسيد المغنيسيوم
الصيغة الكيميائية لبيروكسيد المغنيسيوم هي MgO2. وهذا يعني أن جزيء واحد من بيروكسيد المغنيسيوم يحتوي على ذرة واحدة من المغنيسيوم وذرتين من الأكسجين. الصيغة مهمة لأنها تحدد نوع وعدد الذرات الموجودة في المركب وتساعد في تحديد قياس العناصر الكيميائية للتفاعلات الكيميائية التي تنطوي على بيروكسيد المغنيسيوم.
بيروكسيد المغنيسيوم الكتلة المولية
يحتوي MgO2 على كتلة مولية تبلغ 56304 جم / مول. وهذا يعني أن المول الواحد من MgO2 يحتوي على 56304 جرامًا من المركب. تعد الكتلة المولية خاصية مهمة لـ MgO2 لأنها تساعد في تحديد كمية المادة اللازمة للتفاعلات الكيميائية.
نقطة غليان بيروكسيد المغنيسيوم
ليس لدى MgO2 نقطة غليان محددة لأنه يتحلل قبل أن يغلي. عند تسخينه، فإنه يتحلل إلى أكسيد المغنيسيوم وغاز الأكسجين. هذه الخاصية لـ MgO2 تجعله مفيدًا كمصدر للأكسجين في تطبيقات مختلفة.
نقطة انصهار بيروكسيد المغنيسيوم
MgO2 لديه نقطة انصهار تبلغ 223 درجة مئوية. وهذا يعني أنه عند درجات حرارة أعلى من 700 درجة مئوية، يتحول المركب الصلب إلى سائل. تعد نقطة الانصهار خاصية مهمة لـ MgO2 لأنها تحدد كيفية تصرف المركب عند تعرضه لدرجات حرارة عالية.
كثافة بيروكسيد المغنيسيوم جم / مل
تبلغ كثافة MgO2 2.41 جم/مل. وهذا يعني أن الملليلتر الواحد من MgO2 يزن 2.41 جرام. تعد الكثافة خاصية مهمة لـ MgO2 لأنها تساعد في تحديد كتلة حجم معين من المركب.
الوزن الجزيئي لبيروكسيد المغنيسيوم
الوزن الجزيئي لـ MgO2 هو 56.304 جم / مول. وهذا يعني أن كتلة جزيء واحد من MgO2 تبلغ 56304 وحدة كتلة ذرية. يعد الوزن الجزيئي خاصية مهمة لـ MgO2 لأنه يساعد في تحديد كمية المادة اللازمة للتفاعلات الكيميائية.
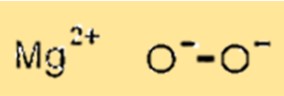
هيكل بيروكسيد المغنيسيوم
يحتوي MgO2 على بنية بلورية حيث تحتل أيونات المغنيسيوم مواقع ثماني السطوح في البنية الشبكية وأيونات الأكسجين التي تحتل مواقع رباعي السطوح. هذا التركيب البلوري مهم لأنه يحدد الخواص الفيزيائية والكيميائية لـ MgO2.
| ملكية | قيمة |
| مظهر | بودرة بيضاء |
| جاذبية معينة | 3.15 جم/سم3 |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 56.304 جم/مول |
| كثافة | 2.41 جم/مل |
| نقطة الانصهار | 223 درجة مئوية |
| نقطة الغليان | ينهار قبل الغليان |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | لا يتحلل في الماء |
| الذوبان | قابل للذوبان في الأحماض |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | غير قابل للتطبيق |
سلامة ومخاطر بيروكسيد المغنيسيوم
يعتبر MgO2 آمنًا بشكل عام عند التعامل معه واستخدامه بشكل صحيح. ومع ذلك، يمكن أن يكون مهيجًا للجلد والعينين والجهاز التنفسي. تناول كميات كبيرة منه قد يسبب تهيج الجهاز الهضمي والقيء والإسهال. من المهم تجنب استنشاق المسحوق وارتداء الملابس والمعدات الواقية عند التعامل معه. إن MgO2 ليس قابلاً للاشتعال أو الانفجار، ولكنه يمكن أن يتفاعل مع بعض المواد الكيميائية مثل الأحماض والمواد المؤكسدة القوية. التخزين والتعامل المناسبان ضروريان لتجنب ردود الفعل العرضية. في حالة تعرضها أو ابتلاعها، اطلب العناية الطبية على الفور.
| رموز الخطر | أوه شي |
| وصف الأمان | قد يسبب بيروكسيد المغنيسيوم تهيج الجلد والعين، وكذلك تهيج الجهاز التنفسي في حالة استنشاقه. قد يكون ضارًا إذا تم ابتلاعه أو ملامسته للجلد وقد يسبب ضررًا خطيرًا للعين. هناك أيضًا خطر نشوب حريق إذا تعرض للحرارة أو اللهب أو المواد المؤكسدة. |
| أرقام تعريف الأمم المتحدة | UN1479 |
| رمز النظام المنسق | 282910 |
| فئة الخطر | 5.1 |
| مجموعة التعبئة | ثانيا |
| تسمم | قد يسبب بيروكسيد المغنيسيوم تهيج الجلد والعين، وكذلك تهيج الجهاز التنفسي في حالة استنشاقه. قد يكون ضارًا إذا تم ابتلاعه أو ملامسته للجلد وقد يسبب ضررًا خطيرًا للعين. هناك أيضًا خطر نشوب حريق إذا تعرض للحرارة أو اللهب أو المواد المؤكسدة. |
طرق تصنيع بيروكسيد المغنيسيوم
هناك عدة طرق لتصنيع MgO2، ولكل منها مزاياها وعيوبها.
تتضمن إحدى الطرق التفاعل بين MgO وبيروكسيد الهيدروجين . في هذه الطريقة، تقوم بخلط MgO مع كمية صغيرة من الماء لتكوين معجون، ثم تضيف بيروكسيد الهيدروجين مع تحريك الخليط. المنتج الناتج هو MgO2 والماء.
تتضمن الطريقة الأخرى التفاعل بين Mg(OH)2 وبيروكسيد الهيدروجين . يذيب الكيميائي Mg(OH)2 في الماء لتكوين محلول، ثم يحرك الخليط مع إضافة بيروكسيد الهيدروجين ببطء. المنتج الناتج هو MgO2 والماء.
الطريقة الثالثة تتضمن التفاعل المباشر بين المغنيسيوم المعدني وغاز الأكسجين عند درجات حرارة عالية. تتطلب هذه الطريقة معدات متخصصة ولا يتم استخدامها بشكل شائع مثل الطرق الأخرى.
استخدامات بيروكسيد المغنيسيوم
يستخدم MgO2 في العديد من الصناعات، بما في ذلك:
- التطبيقات البيئية – يستخدم كمركب لإطلاق الأكسجين في معالجة التربة والمياه الجوفية لتحطيم الملوثات.
- الزراعة – يستخدم كسماد ومحسن للتربة بسبب خصائصه البطيئة إطلاق الأكسجين التي تعزز نمو النبات.
- طبي – يستخدم في بعض تركيبات معجون الأسنان كعامل تبييض وأكسجين لصحة الفم.
- التصنيع الكيميائي – يستخدم في إنتاج المواد الكيميائية المتخصصة مثل الإيبوكسيات والحمضيات والبيريستر.
- تجهيز الأغذية – يستخدم كعامل تبييض في الدقيق والمنتجات الغذائية الأخرى.
- صناعة النسيج – تستخدم كعامل تبييض في إنتاج المنسوجات.
- معالجة المياه – تستخدم لتنقية المياه عن طريق إطلاق الأكسجين وتكسير المركبات العضوية.
أسئلة:
س: ما هو استخدام بيروكسيد المغنيسيوم؟
ج: يستخدم MgO2 في العديد من الصناعات، مثل التطبيقات البيئية، والزراعة، والقطاع الطبي، والتصنيع الكيميائي، وتجهيز الأغذية، وصناعة النسيج ومعالجة المياه.
س: ما هي النواتج عند خلط بيروكسيد الهيدروجين وكبريتات المغنيسيوم؟
ج: عند خلط H2O2 وكبريتات المغنيسيوم، فإن المنتجات المتكونة هي MgO2، والماء، وغاز الأكسجين.
س: هل يستخدم بيروكسيد المغنيسيوم في المختبرات؟
ج: نعم، يستخدم MgO2 في المختبرات لأغراض مختلفة مثل التفاعلات الكيميائية ومعالجة المياه والإصحاح البيئي.
س: هل يقوم المغنيسيوم بتكسير بيروكسيد الهيدروجين؟
ج: لا يقوم المغنيسيوم بتكسير H2O2 من تلقاء نفسه. ومع ذلك، يمكن للمغنيسيوم أن يتفاعل مع H2O2 في وجود محفز، مثل يوديد البوتاسيوم، لإطلاق غاز الأكسجين.
س: أي مما يلي ليس وحدة صيغة صحيحة؟ k2o mgo2 al2o3 sro
ج: Mgo2 ليست وحدة صيغة صحيحة. وحدة الصيغة الصحيحة لأكسيد المغنيسيوم هي MgO.
س: ما هو ناتج (منتجات) هذا التفاعل المشترك؟ MGO + CO2 MGO3 + C mgco3 Mgo2 Mgo + O2 CO2 + O2
ج: المنتج المتكون في التفاعل المشترك لـ mgo وco2 هو mgco3.
س: Mgo2 سائل أم غازي أم صلب؟
ج: Mgo2 مركب صلب.
