بروميد النيكل (NiBr2) مركب كيميائي. وتتكون من ذرة نيكل واحدة وذرتين من البروم. يستخدم عادة في التفاعلات الكيميائية المختلفة وعمليات الحفز.
| اسم الأيوباك | بروميد النيكل (II). |
| الصيغة الجزيئية | NiBr2 |
| CAS رقم | 13462-88-9 |
| المرادفات | ثنائي بروميد النيكل، ثنائي بروميد النيكل، بروميد النيكل |
| إنتشي | InChI=1S/2BrH.Ni/h2*1H;/q;;+2/p-2 |
خصائص بروميد النيكل
صيغة بروميد النيكل
الصيغة الكيميائية لثنائي بروميد النيكل هي NiBr2. وتتكون من ذرة واحدة من النيكل (Ni) وذرتين من البروم (Br). تمثل هذه الصيغة نسبة الذرات في جزيء ثنائي بروميد النيكل.
بروميد النيكل الكتلة المولية
تبلغ الكتلة المولية لثنائي بروميد النيكل (NiBr2) حوالي 218.5 جم/مول. يتم حساب هذه القيمة عن طريق إضافة الكتل الذرية لذرة نيكل واحدة وذرتين من البروم الموجودة في الصيغة.
نقطة غليان بروميد النيكل
يحتوي ثنائي بروميد النيكل على نقطة غليان تبلغ حوالي 1.381 درجة مئوية (2.518 درجة فهرنهايت). تمثل درجة الحرارة هذه النقطة التي يتغير عندها ثنائي بروميد النيكل من السائل إلى الغاز تحت الضغط الجوي القياسي.
نقطة انصهار بروميد النيكل
تبلغ نقطة انصهار ثاني بروميد النيكل حوالي 963 درجة مئوية (1765 درجة فهرنهايت). هذه هي درجة الحرارة التي يتحول عندها ثاني بروميد النيكل الصلب إلى الحالة السائلة.
كثافة بروميد النيكل جم/مل
تبلغ كثافة ثنائي بروميد النيكل حوالي 5.098 جم / مل. تشير قيمة الكثافة هذه إلى كتلة ثنائي بروميد النيكل لكل وحدة حجم وغالبًا ما تستخدم لوصف خصائصه الفيزيائية.
الوزن الجزيئي لبروميد النيكل
يبلغ الوزن الجزيئي لثنائي بروميد النيكل (NiBr2) حوالي 218.5 جم/مول. هذا الوزن هو مجموع الأوزان الذرية لذرات النيكل والبروم المكونة للمركب.
هيكل بروميد النيكل
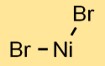
يحتوي ثنائي بروميد النيكل على بنية بلورية في الحالة الصلبة. يتكون المركب من كاتيونات النيكل (Ni) وأنيونات البروميد (Br-) مرتبة في نمط شبكي. يؤدي هذا الترتيب إلى ظهور خصائصه الفيزيائية والكيميائية المتميزة.
ذوبان بروميد النيكل
ثنائي بروميد النيكل قابل للذوبان بشكل معتدل في الماء. تختلف قابليته للذوبان مع درجة الحرارة، حيث يؤدي ارتفاع درجات الحرارة عمومًا إلى زيادة قابلية الذوبان. تلعب هذه الخاصية دورًا في تطبيقاتها في التفاعلات والعمليات الكيميائية المختلفة.
| مظهر | الصلبة والبلورية |
| جاذبية معينة | ~5,098 جم/مل |
| لون | مخضر |
| يشم | عديم الرائحة |
| الكتلة المولية | ~218.5 جم/مول |
| كثافة | ~5,098 جم/مل |
| نقطة الانصهار | ~963 درجة مئوية (1765 درجة فهرنهايت) |
| نقطة الغليان | ~1381 درجة مئوية (2518 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان بشكل معتدل، ويختلف مع درجة الحرارة |
| الذوبان | قابل للذوبان في المذيبات القطبية |
| ضغط البخار | غير محددة بشكل جيد |
| كثافة بخار | غير محددة بشكل جيد |
| pKa | غير محددة بشكل جيد |
| الرقم الهيدروجيني | حيادي |
السلامة ومخاطر بروميد النيكل
يشكل ثنائي بروميد النيكل بعض مخاطر السلامة التي يجب أخذها في الاعتبار. استنشاق غباره أو أبخرةه قد يهيج الجهاز التنفسي ويسبب السعال وصعوبة التنفس. ملامسة الجلد قد تسبب تهيج الجلد أو الحساسية. قد يؤدي تناوله إلى حدوث اضطراب في الجهاز الهضمي. من المهم التعامل مع ثنائي بروميد النيكل بعناية، باستخدام معدات الحماية مثل القفازات والنظارات الواقية. تعتبر التهوية الكافية وإجراءات الحماية الشخصية أمرًا بالغ الأهمية عند العمل مع هذا المركب. ينبغي فهم إجراءات الطوارئ، مثل طلب الرعاية الطبية في حالة التعرض. بشكل عام، يعد التعامل الدقيق والالتزام ببروتوكولات السلامة أمرًا ضروريًا لتقليل المخاطر المرتبطة بثنائي بروميد النيكل.
| رموز الخطر | المخاطر الصحية |
| وصف الأمان | التعامل مع الرعاية. تجنب الاستنشاق وملامسة الجلد. استخدم معدات الحماية المناسبة. |
| أرقام تعريف الأمم المتحدة | UN3260 (لثنائي بروميد النيكل) |
| رمز النظام المنسق | 28275900 (لثنائي بروميد النيكل) |
| فئة الخطر | 8 (المواد المسببة للتآكل) |
| مجموعة التعبئة | الثاني (خطير إلى حد ما) |
| تسمم | سامة إلى حد ما إذا تم ابتلاعها أو استنشاقها. قد يسبب تهيج الجلد والعين. |
طرق تصنيع بروميد النيكل
يمكن تصنيع ثنائي بروميد النيكل بطرق مختلفة. الطريقة الشائعة هي تفاعل أكسيد النيكل (NiO) أو هيدروكسيد النيكل (Ni(OH)2) مع حمض الهيدروبروميك (HBr). ينتج عن هذا التفاعل ثنائي بروميد النيكل مع الماء كمنتج ثانوي. تتضمن الطريقة الأخرى مزيجًا مباشرًا من النيكل المعدني مع البروم الغازي (Br2)، لإنتاج ثنائي بروميد النيكل. بالإضافة إلى ذلك، يمكن أن تتفاعل كربونات النيكل (NiCO3) مع حمض الهيدروبروميك لتكوين مركب البروميد.
بالإضافة إلى ذلك، يمكن لمحلول كلوريد النيكل (NiCl2) أن يتفاعل مع بروميد فلز قلوي، مثل بروميد الصوديوم (NaBr)، لترسيب ثنائي بروميد النيكل. في البيئات الصناعية، يمكن أيضًا استخدام عمليات التحليل الكهربائي، حيث يتم إذابة النيكل في حمض الهيدروبروميك، يليه التحليل الكهربائي لترسيب ثنائي بروميد النيكل.
تتطلب هذه الأساليب الاصطناعية معالجة دقيقة بسبب الطبيعة المسببة للتآكل والسامة للكواشف المعنية. تدابير السلامة المناسبة ومعدات الحماية ضرورية. يعتمد اختيار الطريقة على عوامل مثل النقاء المطلوب وحجم الإنتاج وتوافر الكواشف. إن فهم هذه الطرق يسهل إنتاج ثنائي بروميد النيكل لمختلف التطبيقات في العمليات والأبحاث الكيميائية.
استخدامات بروميد النيكل
يجد ثنائي بروميد النيكل تطبيقات متعددة الاستخدامات في العديد من المجالات نظرًا لخصائصه الفريدة وتفاعله. بعض الاستخدامات البارزة تشمل:
- التحفيز: يعمل ثنائي بروميد النيكل كمحفز في التفاعلات الكيميائية المختلفة، بما في ذلك تفاعلات الاقتران المتقاطع وعمليات البلمرة، وبالتالي تحسين معدلات التفاعل وإنتاجية المنتج.
- الطلاء الكهربائي: تستخدم عمليات الطلاء الكهربائي ترسيب النيكل على الأسطح لتوفير مقاومة للتآكل وتحسين المتانة.
- المستحضرات الصيدلانية: يتضمن تصنيع الوسطيات الصيدلانية استخدام ثنائي بروميد النيكل، مما يساهم في إنتاج أدوية مختلفة.
- صناعة التصوير الفوتوغرافي: يتضمن إعداد الحلول لتطوير وتثبيت المطبوعات الفوتوغرافية استخدام ثنائي بروميد النيكل.
- التخليق العضوي: يستخدم التخليق العضوي ثنائي بروميد النيكل كمادة متفاعلة أو محفز للمساعدة في تكوين مركبات عضوية معقدة.
- الأبحاث المخبرية: تستخدم مختبرات الأبحاث ثاني بروميد النيكل لتسهيل تفاعلات كيميائية معينة، مما يساعد على اكتشاف مركبات جديدة.
- التصنيع الكيميائي: يجد ثنائي بروميد النيكل تطبيقات في إنتاج مركبات النيكل والمواد الكيميائية الأخرى لمختلف الاستخدامات الصناعية.
- كيمياء التنسيق: تلعب خصائص التنسيق لثنائي بروميد النيكل دورًا حاسمًا في دراسة التكوين المعقد في كيمياء التنسيق.
- علم المواد: في علم المواد، يتضمن تغيير وتحسين خصائص المواد من خلال التفاعلات الكيميائية الخاضعة للرقابة استخدام ثنائي بروميد النيكل.
- الرصد البيئي: يمكن اكتشاف وقياس كمية بعض المواد في العينات البيئية من خلال تحليل التتبع باستخدام ثنائي بروميد النيكل.
إن قدرة ثاني بروميد النيكل على التكيف وفائدته في مختلف القطاعات تسلط الضوء على أهميته في البيئات الصناعية والبحثية. تستمر تفاعليته المميزة وخصائصه التحفيزية في المساهمة في التقدم في الكيمياء والتكنولوجيا.
أسئلة:
س: هل ثنائي بروميد النيكل قابل للذوبان؟
ج: ثنائي بروميد النيكل قابل للذوبان بشكل معتدل في الماء.
س: هل ثنائي بروميد النيكل قابل للذوبان في الماء؟
ج: نعم، ثنائي بروميد النيكل قابل للذوبان في الماء بدرجة محدودة.
س: هل بروميد النيكل II قابل للذوبان؟
ج: ثنائي بروميد النيكل II قابل للذوبان في الماء.
س: ما هي صيغة بروميد النيكل (II)؟
ج: صيغة ثاني بروميد النيكل (II) هي NiBr2.
س: هل لخلات النيكل (II) + بروميد الحديد (II) صيغة تجريبية؟
ج: تعتمد الصيغة التجريبية على المواد المتفاعلة؛ وهذا قد لا يؤدي إلى صيغة تجريبية بسيطة.
س: ما هو استخدام بروميد النيكل III؟
ج: ثنائي بروميد النيكل III له استخدام عملي محدود بسبب عدم استقراره وتفاعله.
س: هل بروميد النيكل II أيوني أم جزيئي؟
ج: ثنائي بروميد النيكل II مركب أيوني.
س: ما هو استخدام بروميد النيكل؟
ج: يستخدم ثنائي بروميد النيكل في الحفز الكيميائي والطلاء الكهربائي والتوليف العضوي.
س: هل يشكل NiBr2 + AgNO3 راسبًا؟
ج: نعم، يشكل NiBr2 وAgNO3 راسبًا أصفر اللون (AgBr) بسبب تكوين بروميد الفضة غير القابل للذوبان.
س: هل NiBr2 قابل للذوبان في الماء؟
ج: نعم، NiBr2 قابل للذوبان في الماء.
س:آل+NiBr2→؟
ج: يتفاعل الألومنيوم مع NiBr2 لينتج بروميد الألومنيوم (AlBr3) والنيكل المعدني.
س: اكتب معادلة أيونية صافية متوازنة لتفاعل NiBr2(aq) مع (NH4)2S(aq).
ج: المعادلة الأيونية الصافية: Ni2+ + S2- → NiS(s).
