إيثوكسيد الصوديوم هو قاعدة قوية تتكون من تفاعل الصوديوم مع الإيثانول. يتم استخدامه في التخليق العضوي لتسهيل التفاعلات مثل الأسترة ونزع البروتونات.
| اسم الأيوباك | إيثوكسيد الصوديوم |
| الصيغة الجزيئية | C2H5NaO |
| CAS رقم | 141-52-6 |
| المرادفات | الإيثانول، ملح الصوديوم. إيثوكسيد الصوديوم. إيثيل الصوديوم إيثيلات. كحول إيثيل الصوديوم |
| إنتشي | InChI=1S/C2H5O.Na/c1-2-3;/h2-3H,1H3;/q-1;+1 |
خصائص إيثوكسيد الصوديوم
صيغة إيثوكسيد الصوديوم
الصيغة الكيميائية لإيثوكسيد الصوديوم هي C2H5NaO. وتتكون من ذرتي كربون (C)، وخمس ذرات هيدروجين (H)، وذرة صوديوم واحدة (Na)، وذرة أكسجين واحدة (O). تمثل الصيغة نسبة الذرات الموجودة في جزيء إيثوكسيد الصوديوم.
إيثوكسيد الصوديوم الكتلة المولية
يتم حساب الكتلة المولية لإيثوكسيد الصوديوم عن طريق إضافة الكتل الذرية لجميع الذرات الموجودة في صيغته. الصوديوم (Na) لديه كتلة مولية قدرها 22.99 جم / مول، والكربون (C) لديه كتلة مولية قدرها 12.01 جم / مول، والهيدروجين (H) لديه كتلة مولية قدرها 1.01 جم / مول مول، والأكسجين (O) له كتلة مولية كتلة 1.01 جم / مول. كتلة 16.00 جم / مول. إضافتها تعطي كتلة مولية تبلغ حوالي 68.06 جم/مول لإيثوكسيد الصوديوم.
نقطة غليان إيثوكسيد الصوديوم
يحتوي إيثوكسيد الصوديوم على نقطة غليان تبلغ حوالي 90-95 درجة مئوية (194-203 درجة فهرنهايت). تشير درجة الحرارة هذه إلى النقطة التي يتغير عندها إيثوكسيد الصوديوم من الطور السائل إلى الطور الغازي عند تسخينه تحت ضغط جوي قياسي.
نقطة انصهار إيثوكسيد الصوديوم
تبلغ نقطة انصهار إيثوكسيد الصوديوم حوالي 260-270 درجة مئوية (500-518 درجة فهرنهايت). وهذا يعني درجة الحرارة التي يتغير عندها إيثوكسيد الصوديوم الصلب إلى الحالة السائلة.
كثافة إيثوكسيد الصوديوم جم / مل
تبلغ كثافة إيثوكسيد الصوديوم حوالي 0.868 جم / مل. تشير الكثافة إلى كتلة المادة لكل وحدة حجم ويمكن استخدامها لتحديد ثقلها أو خفة وزنها النسبي مقارنة بحجم متساوٍ من الماء.
الوزن الجزيئي لإيثوكسيد الصوديوم
يبلغ الوزن الجزيئي لإيثوكسيد الصوديوم، والذي يُسمى أيضًا الوزن الجزيئي، حوالي 68.06 جم/مول. ويتم حسابه عن طريق إضافة الكتل الذرية لجميع الذرات الموجودة في جزيء إيثوكسيد الصوديوم.
هيكل إيثوكسيد الصوديوم
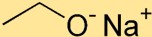
يحتوي إيثوكسيد الصوديوم على بنية ترتبط فيها ذرة الصوديوم (Na) بذرة الأكسجين (O) بواسطة رابطة أيونية. وترتبط مجموعة الإيثوكسيد، المكونة من ذرتي كربون (C) وخمس ذرات هيدروجين (H)، بذرة الصوديوم.
ذوبان إيثوكسيد الصوديوم
إيثوكسيد الصوديوم قابل للذوبان بدرجة عالية في المذيبات القطبية مثل الإيثانول (C2H5OH) والمذيبات العضوية الأخرى. وهو يذوب بسهولة في هذه المذيبات ليشكل محلولاً رائقاً عديم اللون، مما يسهل استخدامه ككاشف في التفاعلات العضوية المختلفة.
| مظهر | صلبة عديمة اللون |
| جاذبية معينة | 0.868 جم/مل |
| لون | عديم اللون |
| يشم | عديم الرائحة |
| الكتلة المولية | 68.06 جم/مول |
| كثافة | 0.868 جم/مل |
| نقطة الانصهار | 260-270 درجة مئوية (500-518 درجة فهرنهايت) |
| نقطة الغليان | 90-95 درجة مئوية (194-203 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | يتفاعل مع الماء |
| الذوبان | قابل للذوبان في الإيثانول (C2H5OH) والمذيبات العضوية الأخرى |
| ضغط البخار | غير متاح |
| كثافة بخار | غير متاح |
| pKa | غير متاح |
| الرقم الهيدروجيني | الأساسية (القلوية) |
السلامة ومخاطر إيثوكسيد الصوديوم
يشكل إيثوكسيد الصوديوم العديد من مخاطر السلامة ويجب توخي الحذر عند التعامل معه. وهي مادة قابلة للتآكل يمكن أن تسبب حروقًا شديدة في الجلد والعينين والجهاز التنفسي. يجب تجنب الاتصال المباشر ويجب ارتداء القفازات والنظارات الواقية والملابس الواقية. يتفاعل بعنف مع الماء، ويطلق غاز الهيدروجين القابل للاشتعال، ويجب تخزينه بعيدًا عن الرطوبة. يمكن أيضًا أن تتفاعل إيثيلات الصوديوم بقوة مع الهواء، مما قد يؤدي إلى نشوب حريق أو انفجار. التهوية الجيدة أمر بالغ الأهمية لمنع تراكم الأبخرة. بالإضافة إلى ذلك، من المهم التعامل مع إيثوكسيد الصوديوم في مختبر مجهز تجهيزًا جيدًا مع موظفين مدربين لتقليل المخاطر وضمان السلامة.
| رموز الخطر | تآكل |
| وصف الأمان | – يسبب حروقًا خطيرة<br>- يتفاعل بعنف عند ملامسة الماء<br>- يحفظ بعيدًا عن الرطوبة<br>- يجب التعامل معه بحذر<br>- استخدم معدات الحماية<br>- يخزن في مكان جاف<br>- تأكد تهوية جيدة |
| أرقام تعريف الأمم المتحدة | UN2922 |
| رمز النظام المنسق | 2905.19.00 |
| فئة الخطر | 8 (المواد المسببة للتآكل) |
| مجموعة التعبئة | ثانيا |
| تسمم | سام إذا تم ابتلاعه أو استنشاقه |
طرق تصنيع إيثوكسيد الصوديوم
هناك عدة طرق لتجميع إيثوكسيد الصوديوم.
تتضمن إحدى طرق تصنيع إيثوكسيد الصوديوم التفاعل بين الصوديوم المعدني والإيثانول . يخضع الصوديوم المعدني لتفاعل الأكسدة والاختزال مع الإيثانول اللامائي، مما يؤدي إلى تكوين إيثوكسيد الصوديوم. لإجراء التفاعل، يمكن إضافة قطع صغيرة من معدن الصوديوم إلى الإيثانول المطلق وإعادة الخليط تحت ظروف خاضعة للرقابة.
تتضمن الطريقة الأخرى التفاعل بين هيدروكسيد الصوديوم (NaOH) والإيثانول . يذوب هيدروكسيد الصوديوم في الإيثانول ويتم تسخين الخليط، مما يعزز التفاعل ليعطي إيثوكسيد الصوديوم. يستخدم الكيميائيون عادة هذه الطريقة عندما لا يفضلون التفاعل المباشر بين الصوديوم المعدني والإيثانول.
وكبديل، يمكنهم تحضير إيثوكسيد الصوديوم عن طريق تفاعل الإيثانول مع كربونات الصوديوم (Na2CO3). قم بإذابة كربونات الصوديوم في الإيثانول ثم قم بتسخين الخليط وحركه. تؤدي هذه العملية إلى تكوين إيثوكسيد الصوديوم.
تجدر الإشارة إلى أن طرق التوليف هذه تتطلب التقيد الصارم باحتياطات السلامة بسبب تفاعل المواد الكيميائية المعنية. يعد التعامل السليم مع المواد القابلة للاشتعال واستخدام معدات الحماية وإجراء التفاعلات في مناطق جيدة التهوية أمرًا ضروريًا للسلامة الشخصية والتخليق الناجح لإيثوكسيد الصوديوم.
استخدامات إيثوكسيد الصوديوم
يجد إيثوكسيد الصوديوم تطبيقات مختلفة بسبب تفاعله وطبيعته الأساسية القوية. فيما يلي بعض الاستخدامات الشائعة:
- التخليق العضوي: يعمل إيثوكسيد الصوديوم على نطاق واسع كقاعدة صلبة في التخليق العضوي. فهو يسهل التفاعلات مثل عمليات الأسترة والتكثيف ونزع البروتون.
- كاشف ألكوكسيد: يعمل بمثابة كاشف ألكوكسيد، والذي يمكن أن يتفاعل مع المركبات العضوية المختلفة لتكوين ألكوكسيدات. تعتبر هذه الألكوكسيدات مواد وسيطة مهمة في العديد من التفاعلات العضوية.
- المحفز: يعمل إيثوكسيد الصوديوم كمحفز في العديد من التفاعلات الكيميائية. إنه يعزز تحويل المركبات العضوية، مثل الكحوليات والإسترات، إلى الإيثرات المقابلة لها أو منتجات الأسترة.
- عامل الجفاف: يجفف المركبات العضوية عن طريق إزالة جزيئات الماء، وبالتالي يسهل تركيب المنتجات اللامائية.
- البلمرة: يشارك إيثوكسيد الصوديوم في تفاعلات البلمرة، بما في ذلك إنتاج البولي إيثيلين تيريفثاليت (PET) وبوليمرات البوليستر الأخرى.
- تصنيع المستحضرات الصيدلانية: يجد تطبيقات في صناعة المستحضرات الصيدلانية لتخليق المركبات الصيدلانية المختلفة بما في ذلك الاسترات والإيثرات والوسائط.
- إنتاج وقود الديزل الحيوي: تستخدم عملية الأسترة التبادلية إيثيلات الصوديوم لتحويل الزيوت النباتية أو الدهون الحيوانية إلى وقود الديزل الحيوي، وهو وقود متجدد وصديق للبيئة.
- كاشف المختبر: يستخدم الباحثون عادةً إيثوكسيد الصوديوم ككاشف للتفاعلات العضوية وفي الإعدادات التجريبية.
أسئلة:
س: هل يعتمد على إيثوكسيد الصوديوم؟
ج: نعم، إيثوكسيد الصوديوم هو قاعدة.
س: هل إيثوكسيد الصوديوم قاعدة قوية أم ضعيفة؟
ج: يعتبر إيثوكسيد الصوديوم قاعدة قوية.
س: ماذا تتوقع إذا أضيف إيثوكسيد الصوديوم إلى الماء؟
ج: إذا تمت إضافة إيثوكسيد الصوديوم إلى الماء، فإنه يتفاعل بقوة، ويطلق غاز الهيدروجين ويشكل هيدروكسيد الصوديوم.
س: هل إيثوكسيد الصوديوم قاعدة قوية أم ضعيفة؟
ج: يعتبر إيثوكسيد الصوديوم قاعدة قوية.
س: هل إيثوكسيد الصوديوم من النيوكليوفيلات القوية؟
ج: نعم، يعتبر إيثوكسيد الصوديوم من النيوكليوفيلات القوية.
س: أي مما يلي هو الأكثر سهولة في تفاعل E2 مع إيثوكسيد الصوديوم؟
ج: إن المركب الذي يحتوي على مجموعة مغادرة أولية أو ثانوية سوف يخضع بسهولة أكبر لتفاعل E2 مع إيثوكسيد الصوديوم.
س: هل إيثوكسيد الصوديوم من النيوكليوفيلات القوية؟
ج: نعم، يعتبر إيثوكسيد الصوديوم من النيوكليوفيلات القوية.
س: هل يعتمد على إيثوكسيد الصوديوم؟
ج: نعم، إيثوكسيد الصوديوم هو قاعدة.
س: أي مما يلي هو الأكثر سهولة في التفاعل مع E2 مع إيثوكسيد الصوديوم (NaOCH2CH3)؟
ج: إن المركب الذي يحتوي على مجموعة مغادرة أولية أو ثانوية سوف يخضع بسهولة أكبر لتفاعل E2 مع إيثوكسيد الصوديوم.
س: هل إيثوكسيد الصوديوم قابل للاشتعال؟
ج: إيثوكسيد الصوديوم نفسه غير قابل للاشتعال، لكنه يتفاعل بعنف مع الماء، ويطلق غاز الهيدروجين القابل للاشتعال.
س: ما هو الشيء الذي ينتج عند دمجه مع الإيثانول إيثوكسيد الصوديوم والهيدروجين؟
ج: ينتج عن اتحاد معدن الصوديوم والإيثانول إيثوكسيد الصوديوم وغاز الهيدروجين.
س: ماذا تتوقع إذا أضيف إيثوكسيد الصوديوم إلى الماء؟
ج: إذا أضيف إيثوكسيد الصوديوم إلى الماء، فإنه يتفاعل بقوة، ويطلق غاز الهيدروجين ويشكل هيدروكسيد الصوديوم.
