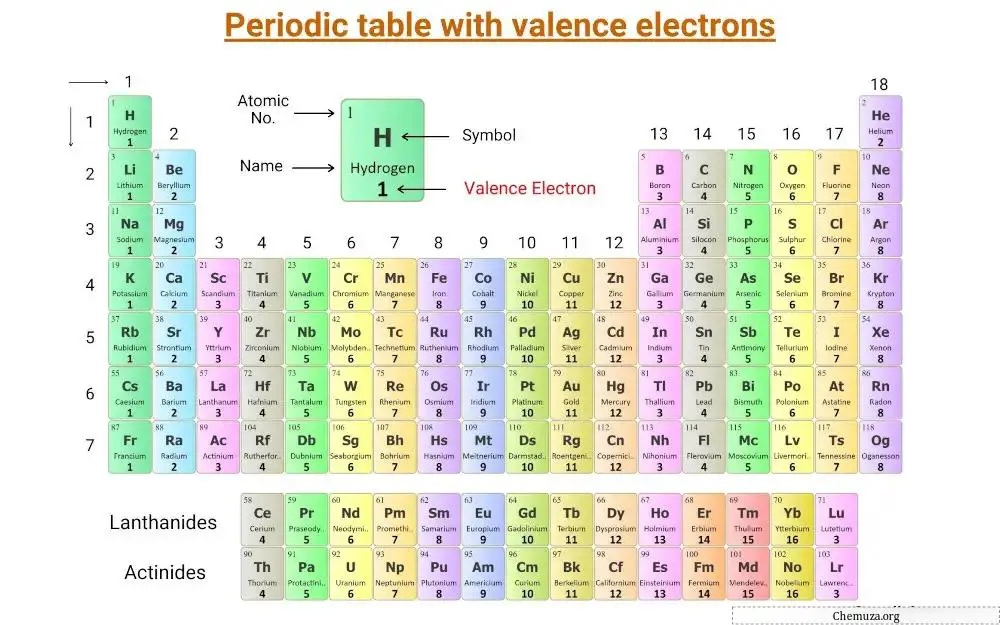
هذا هو الجدول الدوري الذي يتم فيه تصنيف إلكترونات التكافؤ.
دعونا نفهم مفهوم إلكترونات التكافؤ وعدد إلكترونات التكافؤ لعناصر المجموعة الرئيسية والعناصر الانتقالية .
ما هي إلكترونات التكافؤ؟
إلكترونات التكافؤ هي الإلكترونات الموجودة في الغلاف الخارجي أو مستوى الطاقة للذرة التي تشارك في الروابط الكيميائية.
على سبيل المثال، يحتوي المغنيسيوم على إلكترونين في مداره الخارجي، لذا فهو يحتوي على إلكترونين تكافؤ. [1]
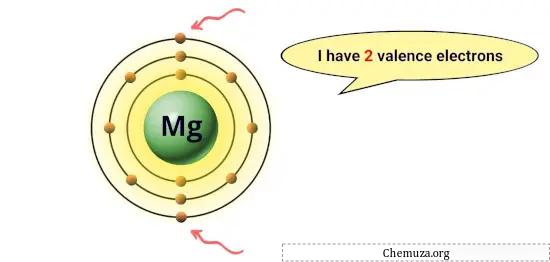
هذه الإلكترونات مسؤولة عن الخواص الكيميائية للعنصر، مثل تفاعله وأنواع الروابط الكيميائية التي يمكن أن تشكلها مع الذرات الأخرى.
يحدد عدد إلكترونات التكافؤ التي تمتلكها الذرة موقعها في الجدول الدوري وقدرتها على تكوين روابط كيميائية .
إلكترونات التكافؤ لعناصر المجموعة الرئيسية
توجد عناصر المجموعة الرئيسية، والتي تسمى أيضًا العناصر التمثيلية، في المجموعات 1 و 2 و 13 إلى 18 من الجدول الدوري.
عدد إلكترونات التكافؤ في هذه العناصر يساوي رقم مجموعتها.
على سبيل المثال، تحتوي عناصر المجموعة 1، مثل الليثيوم والصوديوم ، على إلكترون تكافؤ واحد، بينما تحتوي عناصر المجموعة 2، مثل المغنيسيوم والكالسيوم ، على إلكترونين تكافؤ.
تحتوي عناصر المجموعة 13، مثل البورون والألومنيوم ، على ثلاثة إلكترونات تكافؤ، وهكذا.
تعتبر إلكترونات التكافؤ هذه مسؤولة عن الخواص الكيميائية الفريدة للعناصر وتفاعلها.
إلكترونات التكافؤ للعناصر الانتقالية والداخلية
يعد تحديد إلكترونات التكافؤ للعناصر الانتقالية والعناصر الانتقالية الداخلية أكثر تعقيدًا من تحديد إلكترونات عناصر المجموعة الرئيسية.
في الواقع، الطبقة الفرعية d للعناصر الانتقالية والطبقة الفرعية f للعناصر الانتقالية الداخلية مملوءة بشكل غير كامل وقريبة جدًا من الطبقة الفرعية الخارجية s.
ونتيجة لذلك، فإن إلكترونات المدارين الفرعيين d وs في العناصر الانتقالية والمجالين الفرعيين f وs في العناصر الانتقالية الداخلية يمكن أن تتصرف مثل إلكترونات التكافؤ.
بالنسبة للعناصر الانتقالية، يمكن أن تتراوح إلكترونات التكافؤ من 3 إلى 12 بسبب مساهمة إلكترونات المستوى الفرعي d وs-s. في بعض الحالات، تعتبر الإلكترونات الموجودة في مدارات d غير المكتملة أيضًا إلكترونات تكافؤ. [2]
وبالمثل، بالنسبة للعناصر الانتقالية الداخلية (أو عناصر الكتلة f)، يمكن أن تتراوح إلكترونات التكافؤ من 3 إلى 16 بسبب مساهمة إلكترونات المستوى الفرعي f وs. [3] يمكن أيضًا اعتبار الإلكترونات الموجودة في مدارات d غير المكتملة إلكترونات تكافؤ في بعض الفلزات الانتقالية الداخلية.
من المهم أن نلاحظ أنه بالنسبة للعناصر الانتقالية والداخلية، فإن إلكترونات التكافؤ هي الإلكترونات الموجودة في الأغلفة خارج قلب الغاز النبيل.
