الإيثيلين، المعروف أيضًا باسم الإيثيلين، هو غاز عديم اللون وقابل للاشتعال وذو رائحة حلوة. وهو جزء أساسي من الصناعة الكيميائية، ويستخدم في إنتاج البلاستيك والمذيبات والمواد الكيميائية الأخرى.
| اسم الأيوباك | إيثين |
| الصيغة الجزيئية | C2H4 |
| CAS رقم | 74-85-1 |
| المرادفات | الإيثيلين، الإيثين (خطأ)، الغاز الزيتي، إيلايل، 1،2-ثنائي هيدروجين الإيثيلين |
| إنتشي | إنتشي = 1S/C2H4/c1-2/h1-2H2 |
صيغة الإيثيلين
الصيغة الكيميائية للإيثين هي C2H4. وهو يمثل عدد ونوع الذرات الموجودة في جزيء الإيثين. تُستخدم الصيغة في التفاعلات الكيميائية والحسابات التي تتضمن الإيثيلين، مثل تحديد قياس العناصر الكيميائية للتفاعل أو كمية الإيثيلين المطلوبة لعملية صناعية معينة.
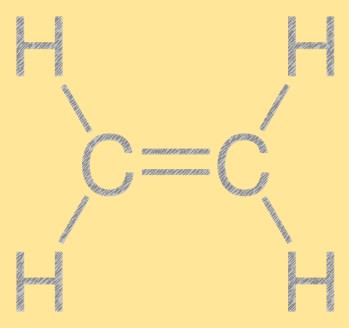
هيكل الإيثيلين
يمتلك الإيثيلين بنية خطية بسيطة، حيث ترتبط ذرتان كربون برابطة مزدوجة وأربع ذرات هيدروجين مرتبطة بكل ذرة كربون. تعتبر الرابطة المزدوجة بين الكربون والكربون مسؤولة عن تفاعل الإيثيلين، مما يجعلها لبنة بناء مفيدة في الصناعة الكيميائية. يحتوي الجزيء على بنية مستوية، حيث تقع جميع الذرات في نفس المستوى.
الإيثين الكتلة المولية
الكتلة المولية للإيثين، المعروف أيضًا باسم الإيثيلين، هي 28.05 جم/مول. وهو جزيء عضوي بسيط يتكون من ذرتي كربون وأربع ذرات هيدروجين، ممثلة بالصيغة الكيميائية C2H4. يتم حساب الكتلة المولية عن طريق إضافة الكتل الذرية للذرات الفردية في الجزيء.
تعد الكتلة المولية عاملاً مهمًا في التفاعلات الكيميائية والحسابات التي تتضمن الإيثيلين. يتم استخدامه لتحديد كمية الإيثيلين اللازمة في التفاعل، وكذلك كمية المنتجات التي يمكن إنتاجها.
نقطة غليان الإيثيلين
نقطة غليان الإيثين هي -103.7 درجة مئوية (-154.7 درجة فهرنهايت). الإيثيلين هو غاز في درجة حرارة وضغط الغرفة، ونقطة غليانه أقل بكثير من درجة غليان الماء، مما يسهل فصله عن المواد الأخرى في العمليات الصناعية.
تعتمد نقطة غليان الإيثين على ضغط العينة ونقاوتها. عند الضغط العالي، تزداد درجة غليان الإيثين. وبالمثل، فإن الشوائب الموجودة في العينة يمكن أن تتسبب في اختلاف درجة الغليان عن القيمة المتوقعة.
نقطة انصهار الإيثين
نقطة انصهار الإيثيلين هي -169.2 درجة مئوية (-272.6 درجة فهرنهايت). الإيثيلين هو جزيء غير قطبي ذو شكل خطي، مما يجعله جزيءًا بسيطًا نسبيًا مقارنة بالعديد من المركبات العضوية الأخرى. وينعكس هذا في نقطة انصهاره المنخفضة.
تمامًا مثل نقطة الغليان، يمكن أن تختلف نقطة انصهار الإيثيلين اعتمادًا على نقاء العينة. يمكن للشوائب أن تخفض درجة الانصهار وتجعل من الصعب الحصول على عينة نقية للأغراض التجريبية.
كثافة الإيثيلين جم/مل
تبلغ كثافة الإيثيلين 0.958 جم/مل في ظل ظروف درجة الحرارة والضغط القياسية (STP)، والتي تُعرف بأنها 0 درجة مئوية (32 درجة فهرنهايت) وضغط 1 جو. الإيثيلين أقل كثافة من الهواء، مما يعني أنه يمكن أن يرتفع وينتشر في الغلاف الجوي.
تعد الكثافة خاصية فيزيائية مهمة للإيثيلين لأنها تستخدم في العمليات الصناعية لتحديد كمية الإيثيلين اللازمة لحجم معين من المساحة. كما أنها تستخدم لحساب كتلة الإيثيلين في العينة.
الوزن الجزيئي للإيثيلين
الوزن الجزيئي للإيثيلين هو 28.05 جم / مول. وهو مجموع الأوزان الذرية للذرات المكونة للجزيء. الوزن الجزيئي هو عامل مهم في العديد من الحسابات الكيميائية، وخاصة في تحديد قياس العناصر الكيميائية للتفاعل وكمية المواد المتفاعلة والمنتجات المطلوبة أو المنتجة.
| مظهر | غاز عديم اللون |
| كثافة محددة | 0.968 جم / مل عند 20 درجة مئوية (68 درجة فهرنهايت) |
| لون | عديم اللون |
| يشم | حلو، حار |
| الكتلة المولية | 28.05 جم/مول |
| كثافة | 0.958 جم / مل عند 0 درجة مئوية و1 أجهزة الصراف الآلي |
| نقطة الانصهار | -169.2 درجة مئوية (-272.6 درجة فهرنهايت) |
| نقطة الغليان | -103.7 درجة مئوية (-154.7 درجة فهرنهايت) عند ضغط 1 جو |
| نقطة فلاش | -136 درجة مئوية (-213 درجة فهرنهايت) |
| الذوبان في الماء | 3.5 جم/لتر عند 25 درجة مئوية (77 درجة فهرنهايت) |
| الذوبان | غير قابلة للذوبان في الماء، قابل للذوبان في المذيبات العضوية |
| ضغط البخار | 114.6 كيلو باسكال عند 20 درجة مئوية (68 درجة فهرنهايت) |
| كثافة بخار | 0.97 (الهواء = 1) |
| pKa | 44 |
| الرقم الهيدروجيني | لا ينطبق، لأن الإيثيلين ليس محلول مائي |
سلامة ومخاطر الإيثيلين
الإيثيلين هو غاز شديد الاشتعال ويمكن أن يشكل مخاليط متفجرة مع الهواء. يمكن أن يشتعل تلقائيًا في الهواء إذا كان التركيز مرتفعًا بدرجة كافية. يعتبر الإيثيلين أيضًا مادة خانقة ويمكن أن يحل محل الأكسجين في الأماكن الضيقة، مما يشكل خطرًا صادمًا.
الاتصال مع الإيثيلين السائل أو التعرض لتركيزات عالية من الغاز قد يسبب قضمة الصقيع أو الحروق. الإيثيلين ليس سامًا، لكن منتجات احتراقه، بما في ذلك أول أكسيد الكربون وثاني أكسيد الكربون، يمكن أن تكون خطرة على صحة الإنسان.
ويتطلب التعامل مع الإيثيلين تدابير السلامة المناسبة، بما في ذلك التهوية الكافية، ومعدات الحماية الشخصية، واحتياطات السلامة من الحرائق. يجب تخزين الإيثيلين ونقله في مناطق جيدة التهوية، بعيداً عن مصادر الاشتعال.
| رموز الخطر | غاز قابل للاشتعال (GHS02)، مادة خانقة بسيطة (GHS09) |
| وصف الأمان | الابتعاد عن مصادر الاشتعال – ممنوع التدخين. استخدم فقط الأدوات التي لا تسبب شرارة. لا تتنفس الغاز. استخدم فقط في الهواء الطلق أو في منطقة جيدة التهوية. ارتداء القفازات الواقية / الملابس الواقية / حماية العين / حماية الوجه. |
| أرقام تعريف الأمم المتحدة | الأمم المتحدة 1962 (الغاز المضغوط) |
| رمز النظام المنسق | 2901.21.00 |
| فئة الخطر | 2.1 (غاز قابل للاشتعال) |
| مجموعة التعبئة | لا يوجد |
| تسمم | غير سام |
طرق تصنيع الإيثيلين
يمكن استخدام طرق مختلفة لتصنيع الإيثيلين، بما في ذلك التكسير الحراري للهيدروكربونات وتجفيف الكحوليات.
في التكسير الحراري، تتضمن العملية تسخين الهيدروكربونات مثل الميثان والبروبان والنافتا عند درجات حرارة عالية (500 إلى 900 درجة مئوية) في وجود محفز لتكسير الجزيئات طويلة السلسلة إلى جزيئات أصغر، وبالتالي إنتاج الإيثيلين. منتجات.
هناك طريقة شائعة أخرى وهي تجفيف الكحول، والتي تتضمن استخدام محفز مثل الألومينا أو السيليكا في درجات حرارة عالية (250-350 درجة مئوية) لتجفيف الإيثانول أو الكحوليات الأخرى وتكوين الإيثيلين والماء.
التكسير بالبخار هو عملية أخرى تستخدم لإنتاج الإيثيلين، حيث يضاف البخار إلى الهيدروكربونات عند درجات حرارة عالية (700-900 درجة مئوية) لتوليد خليط من الإيثيلين ومنتجات أخرى.
يمكن أن يؤدي التحلل الحراري للمواد العضوية مثل الخشب والورق والبلاستيك إلى توليد الإيثيلين.
تشمل الطرق الأخرى لتصنيع الإيثيلين نزع الهيدروجين التأكسدي للإيثان وعملية تحويل الميثانول إلى أوليفينات.
استخدامات الإيثيلين
الإيثيلين مادة كيميائية صناعية مهمة لها نطاق واسع من الاستخدامات.
- يلعب الإيثيلين دوراً حاسماً في إنتاج البولي إيثيلين، وهو أحد أكثر المواد البلاستيكية استخداماً في العالم. يستخدم الناس البولي إيثيلين في تطبيقات مختلفة مثل التغليف والأنابيب ومواد البناء.
- يستخدم المصنعون الإيثيلين كعنصر رئيسي في إنتاج البوليمرات الأخرى، مثل كلوريد البولي فينيل (PVC). PVC مفيد في مواد البناء والأجهزة الطبية والكابلات الكهربائية.
- كما يعتبر الإيثيلين عنصرا حاسما في تصنيع أكسيد الإيثيلين، وهو مادة خام أساسية في صناعة المنظفات والمذيبات والبلاستيك.
- يستخدم المصنعون الإيثيلين لإنتاج جلايكول الإثيلين، وهو مبرد ومضاد للتجمد للمحركات. وهي أيضًا مادة خام تدخل في صناعة ألياف البوليستر والأفلام والراتنجات.
- يستخدم الإيثيلين كوقود للحام وقطع المعادن. كما أنه يعمل كعامل إنضاج للفواكه والخضروات.
- الإيثيلين مفيد في تخليق المركبات العضوية المختلفة، بما في ذلك الإيثانول والأسيتالديهيد.
وبشكل عام، فإن تعدد استخدامات الإيثيلين يجعله عنصرًا أساسيًا في مجموعة واسعة من العمليات الصناعية، مما يساهم في العديد من جوانب الحياة الحديثة.
أسئلة:
ما هي مركبات الديين التي تتفاعل مع الإيثيلين في تفاعل ديلز-ألدر؟
يمكن لأي ديين يحتوي على رابطتين مزدوجتين مترافقتين أن يخضع لتفاعل ديلز ألدر مع الإيثين. تتضمن أمثلة هذه الديينات 1،3-بوتادين وإيزوبرين.
كيف يتم ترتيب ذرات الهيدروجين في الإيثين؟
في الإيثين، ترتبط ذرتا الكربون ببعضهما البعض بواسطة رابطة مزدوجة. ترتبط كل ذرة كربون أيضًا بذرتي هيدروجين، مع احتلال التكافؤ المتبقي بزوجين غير مشتركين من الإلكترونات على كل ذرة كربون. ترتيب الذرات حول كل ذرة كربون هو ترتيب ثلاثي.
ما عدد روابط pi التي تتكون عند حدوث تهجين sp2 في الإيثين C2H4؟
عندما يحدث تهجين sp2 في الإيثين، تتشكل رابطة باي بين ذرتي الكربون. تشارك المدارات الهجينة sp2 في تكوين روابط سيجما بين ذرات الكربون وذرات الهيدروجين، بينما تتداخل المدارات p لكل ذرة كربون لتشكل الرابطة باي. يصنف الإيثيلين على أنه هيدروكربون غير مشبع لأنه يحتوي على رابطة مزدوجة بين ذرتي الكربون. تتكون هذه الرابطة المزدوجة من رابطة سيجما واحدة ورابطة باي واحدة، مما يعني أن الإيثين يحتوي على ذرات هيدروجين أقل من الهيدروكربون المشبع المماثل الذي يحتوي على نفس العدد من ذرات الكربون.
