L’aniline (C6H5NH2) est une amine aromatique utilisée dans la production de colorants, de produits pharmaceutiques et de produits chimiques pour le caoutchouc. Il a une odeur distincte et est un précurseur de divers composés organiques.
| Nom UICPA | Aniline |
| Formule moléculaire | C6H7N |
| Numero CAS | 62-53-3 |
| Synonymes | Aminobenzène, Benzénamine |
| InChI | InChI=1S/C6H7N/c7-6-4-2-1-3-5-6/h1-5H,7H2 |
Propriétés de l’aniline
Formule aniline
La formule de l’aniline est C6H7N. Il se compose de six atomes de carbone, sept atomes d’hydrogène et un atome d’azote. La disposition de ces atomes confère à l’aniline ses propriétés chimiques uniques.
Aniline Masse molaire
La masse molaire de C6H5NH2 est calculée en additionnant les masses atomiques de tous ses éléments constitutifs. La masse molaire du C6H5NH2 est d’environ 93,13 grammes par mole (g/mol). Cette valeur est utile dans divers calculs chimiques et réactions impliquant C6H5NH2.
Point d’ébullition de l’aniline
C6H5NH2 a un point d’ébullition d’environ 184 degrés Celsius (184°C). À cette température, C6H5NH2 subit un changement de phase de l’état liquide à l’état gazeux. Le point d’ébullition est une caractéristique importante qui détermine les conditions dans lesquelles le C6H5NH2 peut être vaporisé.
Aniline Point de fusion
Le point de fusion du C6H5NH2 est d’environ -6 degrés Celsius (-6°C). C’est la température à laquelle le solide C6H5NH2 se transforme à l’état liquide. Le point de fusion est important pour déterminer l’état physique du C6H5NH2 dans différentes conditions de température.
Densité d’aniline g/mL
C6H5NH2 a une densité d’environ 1,02 grammes par millilitre (g/mL). La densité représente la masse d’une substance par unité de volume. La valeur de densité de C6H5NH2 fournit des informations sur sa compacité ou sa concentration dans un volume d’espace donné.
Aniline Poids moléculaire
Le poids moléculaire du C6H5NH2 est d’environ 93,13 grammes par mole (g/mol). C’est la somme des poids atomiques de tous les atomes de la formule chimique de C6H5NH2. Le poids moléculaire joue un rôle crucial dans les calculs stœchiométriques et dans la détermination de la quantité de C6H5NH2 nécessaire aux réactions.
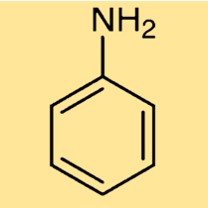
Structure aniline
C6H5NH2 a une structure constituée d’un cycle benzénique (un cycle hexagonal d’atomes de carbone) avec un groupe amino attaché (-NH2) à la place d’un atome d’hydrogène. Cette structure confère au C6H5NH2 ses propriétés aromatiques et basiques, le rendant utile dans diverses applications industrielles.
Solubilité de l’aniline
Le C6H5NH2 est peu soluble dans l’eau mais se dissout facilement dans les solvants organiques tels que l’éthanol, l’éther et le chloroforme. Sa solubilité est influencée par la polarité et les forces intermoléculaires entre C6H5NH2 et le solvant. Cette propriété permet au C6H5NH2 d’être facilement incorporé dans différents procédés et formulations chimiques.
| Apparence | Liquide incolore à jaune pâle |
| Gravité spécifique | 1,02 g/ml |
| Couleur | Incolore à jaune pâle |
| Odeur | Odeur caractéristique |
| Masse molaire | 93,13 g/mole |
| Densité | 1,02 g/ml |
| Point de fusion | -6°C |
| Point d’ébullition | 184°C |
| Point d’éclair | 70°C |
| Solubilité dans l’eau | Peu soluble |
| Solubilité | Soluble dans les solvants organiques |
| Pression de vapeur | 5,60 mmHg |
| Densité de vapeur | 3,24 (air=1) |
| pKa | 4.61 |
| pH | Approximativement neutre |
Sécurité et dangers de l’aniline
Le C6H5NH2 présente des risques potentiels pour la sécurité et doit être manipulé avec prudence. Il est nocif s’il est avalé, inhalé ou absorbé par la peau. Le contact direct avec le C6H5NH2 peut provoquer une irritation des yeux, de la peau et du système respiratoire. Une exposition prolongée ou répétée peut entraîner des effets plus graves, notamment des dermatites et des troubles sanguins. Le C6H5NH2 est également inflammable et ses vapeurs peuvent former des mélanges explosifs dans l’air. Une ventilation adéquate et un équipement de protection individuelle doivent être utilisés lorsque vous travaillez avec du C6H5NH2. Des pratiques appropriées de stockage, de manipulation et d’élimination sont essentielles pour minimiser les risques et garantir la sécurité des personnes et de l’environnement.
| Symboles de danger | T, N |
| Description de la sécurité | Eviter le contact avec la peau et les yeux. Utiliser dans un endroit bien ventilé. Manipuler avec des gants et des vêtements de protection. |
| Numéros d’identification de l’ONU | ONU 1547 |
| Code SH | 2921.43.0000 |
| Classe de danger | 6.1 (Substances toxiques) |
| Groupe d’emballage | III |
| Toxicité | Toxique en cas d’ingestion, d’inhalation ou d’absorption par la peau. Peut provoquer une irritation, une dermatite et des troubles sanguins. |
Méthodes de synthèse de l’aniline
Diverses méthodes peuvent synthétiser C6H5NH2.
Une méthode courante est la réduction du nitrobenzène . Dans ce procédé, un agent réducteur, tel que la limaille de fer ou l’étain, réagit avec le nitrobenzène en présence d’un acide fort, tel que l’acide chlorhydrique. Cette réaction entraîne la conversion du groupe nitro (-NO2) en un groupe amino (-NH2), produisant du C6H5NH2.
Une autre méthode implique la réduction du nitrobenzène en utilisant de l’hydrogène gazeux sur un catalyseur, tel que le palladium ou le platine. La méthode industrielle de production de C6H5NH2 utilise largement le procédé appelé hydrogénation catalytique.
Pour obtenir du C6H5NH2, on peut utiliser du sulfure de sodium ou du bisulfite de sodium dans la réduction du nitrobenzène . Ces agents réducteurs facilitent la conversion du groupe nitro en groupe amino.
Pour synthétiser le C6H5NH2, on peut traiter le chlorobenzène avec de l’ammoniac en présence d’une base forte, comme la soude. Ce processus, connu sous le nom de réaction de Sandmeyer, entraîne la substitution du chlore par un groupe amino, donnant C6H5NH2.
De plus, on peut préparer du C6H5NH2 en réduisant l’azobenzène ou l’azoxybenzène, ce qui implique de rompre la liaison azote-azote pour former un groupe amino.
Ces méthodes de synthèse proposent différentes approches pour obtenir du C6H5NH2, permettant sa production à l’échelle du laboratoire et de l’industrie. Le choix de la méthode dépend de facteurs tels que la disponibilité des matières premières, les conditions de réaction et la pureté souhaitée du produit final.
Utilisations de l’aniline
Le C6H5NH2 trouve des applications dans diverses industries en raison de ses diverses propriétés. Voici quelques-unes de ses utilisations courantes :
- Production de colorants : le C6H5NH2 sert de matière première clé pour la fabrication de nombreux colorants, notamment des colorants et pigments synthétiques utilisés dans les industries du textile, du cuir et du papier.
- Industrie pharmaceutique : les dérivés C6H5NH2 sont cruciaux dans la synthèse de médicaments pharmaceutiques, tels que les analgésiques, les antipyrétiques et les agents antipaludiques.
- Produits chimiques pour le caoutchouc : C6H5NH2 améliore activement les performances et la durabilité des produits en caoutchouc en étant un composant crucial dans la production d’accélérateurs et d’antioxydants au sein de l’industrie du caoutchouc.
- Herbicides et pesticides : les agriculteurs utilisent activement les dérivés C6H5NH2 dans la formulation d’herbicides et de pesticides, contrôlant ainsi efficacement les mauvaises herbes et les ravageurs en agriculture.
- Production de polyuréthane : le C6H5NH2 est un composant essentiel dans la synthèse de mousses, revêtements et adhésifs polyuréthane, largement utilisés dans les industries de la construction et de l’automobile.
- Intermédiaires chimiques : C6H5NH2 sert d’élément de base polyvalent pour la synthèse de divers composés organiques, tels que les produits chimiques à base de caoutchouc, les produits pharmaceutiques et les produits agrochimiques.
- Solvant pour diverses substances : C6H5NH2 dissolvant activement diverses substances, notamment les graisses, les huiles, les cires et les résines.
- Réactif de laboratoire : Dans les expériences de laboratoire de synthèse organique, les chercheurs utilisent le C6H5NH2 comme réactif et l’utilisent comme catalyseur dans certaines réactions.
- Produits chimiques photographiques : les dérivés C6H5NH2 contribuent activement à la production de produits chimiques photographiques, tels que les révélateurs et les colorants.
- Initiateur de polymérisation : C6H5NH2 agit comme initiateur dans certaines réactions de polymérisation, permettant la formation de polymères aux propriétés spécifiques.
Ces diverses applications mettent en évidence l’importance du C6H5NH2 dans des industries allant du textile et des produits pharmaceutiques à l’agriculture et à l’industrie manufacturière.
Des questions:
Q : Quel composé est plus basique que l’aniline ?
R : L’ammoniac (NH3) est plus basique que le C6H5NH2.
Q : Qu’est-ce que le point d’aniline ?
R : Le point C6H5NH2 est la température la plus basse à laquelle des volumes égaux de C6H5NH2 et un solvant spécifique sont complètement miscibles.
Q : Qu’est-ce que l’aniline ?
R : L’aniline est une amine aromatique de formule chimique C6H7N, couramment utilisée dans les colorants, les produits pharmaceutiques et les produits chimiques pour le caoutchouc.
Q : Comment séparer le naphtalène et l’aniline ?
R : Le naphtalène et le C6H5NH2 peuvent être séparés par un processus appelé distillation fractionnée, en utilisant la différence de leurs points d’ébullition.
Q : Comment le phénol est-il préparé à partir de l’aniline ?
R : Le phénol peut être synthétisé à partir de C6H5NH2 par un processus appelé diazotation, suivi d’une hydrolyse pour former du phénol.
Q : Comment nettoyer le cuir aniline ?
R : Pour nettoyer le cuir C6H5NH2, utilisez un chiffon doux et humide pour enlever délicatement les taches et évitez d’utiliser des produits chimiques agressifs ou une humidité excessive.
Q : Quelle est la base conjuguée de l’acide benzoïque et l’acide conjugué de l’aniline ?
R : La base conjuguée de l’acide benzoïque est l’ion benzoate (C6H5COO-) et l’acide conjugué de C6H5NH2 est l’ion anilinium (C6H5NH3+).
Q : Qu’est-ce que le cuir aniline ?
R : Le cuir C6H5NH2 est un type de cuir teint avec des colorants C6H5NH2, préservant la texture et l’apparence naturelles du cuir tout en conservant une sensation douce et luxueuse.
