Qu’est-ce que l’ammoniac ?
L’ammoniac ou NH3 est un gaz incolore et piquant composé d’azote et d’hydrogène, largement utilisé dans l’industrie comme réfrigérant, agent de nettoyage et engrais.
| Nom UICPA | Ammoniac |
| Formule moléculaire | NH3 |
| Numero CAS | 7664-41-7 |
| Synonymes | Azane, trihydrure d’azote, alcool de Hartshorn |
| InChI | InChI=1S/NH3/c1-2 |
Propriétés de l’ammoniac
Structure de Lewis pour l’ammoniac
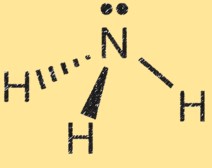
La structure de Lewis de l’ammoniac (NH3) montre la disposition des électrons dans la molécule. Dans une structure de Lewis, les points représentent les électrons et les lignes représentent les liaisons entre atomes.
La structure de Lewis de l’ammoniac montre l’atome d’azote entouré de trois atomes d’hydrogène et d’une paire d’électrons partagés entre les atomes d’azote et d’hydrogène. Cela représente les liaisons covalentes dans la molécule. L’atome d’azote a cinq électrons de valence et les atomes d’hydrogène ont chacun un électron de valence. Dans la structure de Lewis de l’ammoniac, l’atome d’azote forme trois liaisons simples avec les atomes d’hydrogène et possède une paire d’électrons non partagée.
Formule d’ammoniac
La formule chimique de l’ammoniac est NH3. La formule indique qu’il y a trois atomes d’hydrogène et un atome d’azote dans chaque molécule d’ammoniac. La formule représente la composition de la substance et fournit des informations importantes sur ses propriétés et son comportement.
NH3 Masse molaire
La masse molaire d’une substance est la masse d’une mole de la substance et est exprimée en grammes par mole. La masse molaire de l’ammoniac (NH3) est de 17,0307 g/mol. Cela signifie qu’une mole d’ammoniac a une masse de 17,0307 grammes. La masse molaire d’une substance est importante pour déterminer le nombre de moles dans un échantillon donné et peut être utilisée pour déterminer la masse de formule d’un composé.
Point d’ébullition de l’ammoniac
Le NH3 a un point d’ébullition de -33,34 °C (-28,012 °F). Le point d’ébullition d’une substance est la température à laquelle sa pression de vapeur est égale à la pression atmosphérique et elle commence à passer d’un liquide à un gaz. Le point d’ébullition du NH3 est relativement bas par rapport à d’autres produits chimiques, ce qui en fait un réfrigérant utile dans les systèmes de refroidissement et de réfrigération.
NH3 Point de fusion
Le NH3 a un point de fusion de -77,73 °C (-107,87 °F). Le point de fusion d’une substance est la température à laquelle elle passe d’un solide à un liquide. Le faible point de fusion du NH3 en fait un réfrigérant utile, car il peut être facilement condensé d’un gaz à un liquide, lui permettant d’absorber la chaleur lorsqu’il change d’état.
NH3 Densité g/ml
La densité d’une substance est la masse d’un échantillon par unité de volume. La densité du NH3 est de 0,769 g/mL. Cela signifie qu’un millilitre de NH3 a une masse de 0,769 gramme. La densité d’une substance peut être utilisée pour déterminer la quantité de matière présente dans un volume donné et constitue une propriété importante pour comprendre le comportement d’une substance dans différents états.
NH3 Poids moléculaire
Le poids moléculaire d’une substance est la somme des poids atomiques de tous les atomes d’une seule molécule de la substance. Le poids moléculaire du NH3 (NH3) est de 17,0307 g/mol. Cela signifie qu’une molécule de NH3 a un poids moléculaire de 17,0307 grammes par mole. Le poids moléculaire d’une substance est important pour déterminer le nombre de moles dans un échantillon donné et peut être utilisé pour déterminer la masse de formule d’un composé.
Structure NH3
NH3 est une molécule composée de trois atomes d’hydrogène et d’un atome d’azote. L’atome d’azote est lié aux atomes d’hydrogène via une liaison covalente et la molécule a une forme pyramidale trigonale. Les angles de liaison dans la molécule sont d’environ 107°. Le NH3 est une molécule polaire, ce qui signifie qu’il a une extrémité positive et négative, et est couramment utilisé comme solvant et réactif dans les réactions chimiques.
| Apparence | Gaz incolore |
| Gravité spécifique | 0,59 (air = 1) |
| Couleur | Incolore |
| Odeur | Odeur âcre et forte |
| Masse molaire | 17,0307 g/mole |
| Densité | 0,769 g/mL |
| Point de fusion | -77,73 °C |
| Point d’ébullition | -33,34 °C |
| Point d’éclair | Sans objet (gaz) |
| Solubilité dans l’eau | Très soluble |
| Solubilité | Soluble dans l’eau et la plupart des solvants organiques |
| Pression de vapeur | 50,7 kPa à 20°C |
| Densité de vapeur | 0,59 (air = 1) |
| pKa | 4,75 |
| pH | 11,6 (solution saturée) |
Sécurité et dangers liés à l’ammoniac
Le NH3 est un gaz hautement toxique et corrosif qui peut nuire gravement à la santé humaine et à l’environnement s’il n’est pas manipulé correctement. Le NH3 peut provoquer de graves brûlures aux yeux, à la peau et aux voies respiratoires, et peut également être mortel s’il est inhalé à fortes concentrations. De plus, le NH3 est très réactif et peut s’enflammer ou exploser s’il entre en contact avec certains produits chimiques ou matériaux.
Il est important de prendre des précautions de sécurité lors de la manipulation ou du travail avec du NH3. Cela inclut le port de vêtements de protection, tels que des gants, des lunettes de protection et un masque facial, ainsi qu’une ventilation adéquate pour éviter d’inhaler le gaz. Il est également important de stocker le NH3 dans des zones bien ventilées, loin des sources de chaleur et autres matériaux inflammables. En cas d’exposition au NH3, il est important de retirer les vêtements contaminés et de rincer la zone affectée à grande eau. Consulter immédiatement un médecin si des symptômes d’exposition apparaissent.
| Symboles de danger | T+, N |
| Description de la sécurité | Dangereux pour l’environnement, nocif par inhalation, irritant |
| Identifiants ONU | ONU 1005 |
| Code SH | 2814.1 |
| Classe de danger | 2.3 |
| Groupe d’emballage | II |
| Toxicité | Dose hautement toxique et mortelle (inhalation) – 33-66 ppm |
Méthodes de synthèse de l’ammoniac
Il existe plusieurs méthodes de synthèse de l’ammoniac, notamment le procédé Haber, le procédé Ostwald et le procédé Birkeland-Eyde.
Le procédé Haber, également connu sous le nom de procédé Haber-Bosch, est la méthode la plus utilisée pour la synthèse industrielle de l’ammoniac. Dans ce processus, l’azote gazeux de l’air réagit avec l’hydrogène gazeux sur un catalyseur en fer pour former de l’ammoniac. La réaction a lieu sous haute pression (environ 150 atmosphères) et à une température de 450-500°C. Le procédé Haber est très efficace, produisant de grandes quantités d’ammoniac avec un rendement élevé, et est utilisé comme principale source d’ammoniac pour la production d’engrais et d’autres produits chimiques.
Le procédé Ostwald, également connu sous le nom de procédé de fixation de l’azote, est une méthode plus ancienne de synthèse de l’ammoniac qui implique l’oxydation de l’azote gazeux en oxyde nitrique, suivie de la réaction de l’oxyde nitrique avec davantage d’azote gazeux pour former de l’ammoniac. Ce procédé est moins efficace et a été largement remplacé par le procédé Haber.
Le procédé Birkeland-Eyde, également connu sous le nom de procédé plasma, est une méthode plus récente de synthèse d’ammoniac qui utilise une décharge plasma pour dissocier les gaz azote et hydrogène et former de l’ammoniac. Ce procédé est encore en phase de développement et n’a pas été largement adopté pour une utilisation industrielle.
En résumé, le procédé Haber est la méthode la plus couramment utilisée pour la synthèse de l’ammoniac, tandis que le procédé Ostwald et le procédé Birkeland-Eyde sont des méthodes plus anciennes ou moins largement utilisées.
Utilisations de l’ammoniac
L’ammoniac est un produit chimique polyvalent qui a un large éventail d’utilisations dans l’industrie et l’agriculture. Certaines des principales utilisations de l’ammoniac comprennent :
- Production d’engrais : Principal ingrédient de la production d’engrais azotés, l’ammoniac augmente les rendements des cultures et améliore la fertilité des sols.
- Réfrigération : les systèmes de réfrigération industriels et domestiques utilisent l’ammoniac comme réfrigérant, y compris les réfrigérateurs et les congélateurs.
- Nettoyage : Les produits de nettoyage ménagers contiennent souvent de l’ammoniaque en raison de sa capacité à dissoudre la graisse et la saleté.
- Produits pharmaceutiques : La production de divers produits pharmaceutiques, tels que les antiacides et les sirops contre la toux, utilise l’ammoniac comme matière première.
- Production textile : La teinture et l’impression des textiles, ainsi que la production de fibres synthétiques, utilisent de l’ammoniac.
- Traitement des déchets : Le traitement des eaux usées et le contrôle des odeurs provenant des stations d’épuration impliquent l’utilisation d’ammoniac.
- Retardateurs de flamme : L’ammoniac agit comme ignifuge dans la production de matériaux tels que les plastiques, les caoutchoucs et autres.
- Production pétrolière et gazière : L’industrie pétrolière et gazière utilise l’ammoniac pour produire divers produits chimiques, notamment des tensioactifs et des désémulsifiants.
En conclusion, l’ammoniac est un produit chimique polyvalent qui a un large éventail d’utilisations dans diverses industries et applications, notamment l’agriculture, la réfrigération, le nettoyage, les produits pharmaceutiques, la production textile, le traitement des déchets, les retardateurs de flamme et la production pétrolière et gazière.
Des questions:
L’ammoniac est-il un acide ou une base ?
L’ammoniac est considéré comme une base. Dans les solutions aqueuses, il se dissout pour former des ions hydroxyde (OH-) et agit comme une base faible. L’ammoniac a un pH basique (alcalin), généralement autour de 11. Les solutions d’ammoniac peuvent neutraliser les acides pour former du sel et de l’eau, ce qui est l’une des caractéristiques déterminantes d’une base. Dans les réactions chimiques, l’ammoniac peut également agir comme nucléophile et participer à des réactions qui forment des amides, qui sont des dérivés de l’ammoniac et contiennent la liaison azote-carbone caractéristique des amines et des amides.
L’ammoniac est-il polaire ?
Oui, l’ammoniac est polaire. Il a une géométrie moléculaire courbée avec un atome d’azote central entouré de trois atomes d’hydrogène. Cette forme crée un moment dipolaire permanent, l’extrémité positive du dipôle étant située au niveau des atomes d’hydrogène et l’extrémité négative étant située au niveau de l’atome d’azote. La nature polaire de l’ammoniac lui permet de se dissoudre dans des solvants polaires comme l’eau, ce qui est une caractéristique des molécules polaires. La nature polaire de l’ammoniac lui permet également de participer à la liaison hydrogène, qui est un type de force intermoléculaire qui se produit entre les molécules polaires. Cette liaison hydrogène peut conduire à des points d’ébullition et de fusion plus élevés que ceux des molécules non polaires de taille similaire.
