L’amidure de sodium (NaNH2) est un composé chimique. Il est constitué d’atomes de sodium et d’azote. Il est utilisé comme base forte dans diverses réactions chimiques.
| Nom UICPA | Amidure de sodium |
| Formule moléculaire | NaNH2 |
| Numero CAS | 7782-92-5 |
| Synonymes | Sodamide, azanide de sodium, amide de sodium, nitrure de sodium |
| InChI | InChI=1S/NaN2/c2-1-3/q-1 |
Propriétés de l’amidure de sodium
Formule d’amide de sodium
La formule de l’amidure de sodium est NaNH2. Il se compose d’un atome de sodium (Na), d’un atome d’hydrogène (H) et d’un atome d’azote (N). Cette formule chimique représente la composition de l’amidure de sodium au niveau moléculaire.
Amide De Sodium Masse molaire
La masse molaire de l’azanide de sodium est calculée en additionnant les masses atomiques de ses éléments constitutifs. Le sodium a une masse atomique de 22,99 grammes par mole (g/mol) et l’azote a une masse atomique de 14,01 g/mol. En additionnant ces valeurs, on constate que la masse molaire de l’azanide de sodium est d’environ 39 g/mol.
Point d’ébullition de l’amidure de sodium
Le point d’ébullition de l’azanide de sodium est la température à laquelle il passe d’un liquide à un gaz. L’azanide de sodium a un point d’ébullition relativement élevé d’environ 850 degrés Celsius (°C). À cette température, les forces intermoléculaires qui maintiennent ensemble les molécules d’azanide de sodium sont surmontées, entraînant la conversion de l’état liquide à l’état gazeux.
Amide de sodium Point de fusion
Le point de fusion de l’azanide de sodium est la température à laquelle il passe d’un solide à un liquide. L’azanide de sodium a un point de fusion relativement bas d’environ 210 degrés Celsius (°C). À cette température, la structure du réseau cristallin de l’azanide de sodium solide se décompose, permettant aux particules de se déplacer librement, formant un liquide.
Densité d’amide de sodium g/mL
La densité de l’azanide de sodium est une mesure de sa masse par unité de volume. La densité de l’azanide de sodium est d’environ 1,39 grammes par millilitre (g/mL). Cette valeur indique que l’azanide de sodium est une substance relativement dense.
Amide De Sodium Poids moléculaire
Le poids moléculaire de l’azanide de sodium est la somme des poids atomiques de tous les atomes de sa formule chimique. Le poids moléculaire de l’azanide de sodium est d’environ 39 grammes par mole (g/mol).
Structure de l’amide de sodium
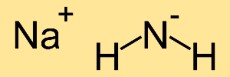
La structure de l’azanide de sodium est constituée d’un atome de sodium (Na) lié à deux atomes d’azote (N). Les atomes d’azote forment un arrangement linéaire avec l’atome de sodium au milieu, ce qui donne une structure moléculaire linéaire.
Solubilité de l’amide de sodium
L’azanide de sodium est peu soluble dans l’eau. Il réagit avec l’eau pour former de l’hydroxyde de sodium (NaOH) et de l’ammoniac (NH3). Cependant, il est soluble dans certains solvants organiques comme l’ammoniaque liquide et les alcools liquides. La solubilité de l’azanide de sodium dans ces solvants permet son utilisation dans diverses réactions chimiques.
| Apparence | Solide blanc |
| Gravité spécifique | 1,39 g/ml |
| Couleur | Blanc |
| Odeur | Similaire à l’ammoniac |
| Masse molaire | 39 g/mole |
| Densité | 1,39 g/ml |
| Point de fusion | 210 °C |
| Point d’ébullition | 850 °C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Réagit |
| Solubilité | Soluble dans les solvants organiques tels que l’ammoniac liquide et les alcools liquides |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | Alcalin (au-dessus de 7) |
Sécurité et dangers de l’amide de sodium
L’azanide de sodium présente certains risques et dangers pour la sécurité qui doivent être pris en compte. Il réagit violemment avec l’eau, libérant du gaz ammoniac toxique et de l’hydroxyde de sodium corrosif. Il doit donc être manipulé avec une extrême prudence pour éviter tout contact avec l’humidité ou l’eau. L’azanide de sodium est également une base forte, qui peut provoquer de graves brûlures et lésions oculaires au contact de la peau ou des yeux. L’inhalation de ses poussières ou de ses vapeurs peut irriter le système respiratoire. Il est conseillé de porter un équipement de protection approprié, tel que des gants, des lunettes et un respirateur, lorsque vous travaillez avec de l’azanide de sodium. Une ventilation adéquate et un stockage à l’écart des substances incompatibles sont des mesures de sécurité essentielles.
| Symboles de danger | Corrosif, Nocif, Toxique |
| Description de la sécurité | Manipulez avec une extrême prudence. Évitez tout contact avec l’eau/l’humidité. Portez un équipement de protection. Une ventilation et un stockage adéquats sont requis. |
| Numéros d’identification de l’ONU | ONU 1410 |
| Code SH | 28500020 |
| Classe de danger | 4.3 (Dangereux lorsqu’il est mouillé), 6.1 (Toxique), 8 (Corrosif) |
| Groupe d’emballage | II |
| Toxicité | Toxique par ingestion, inhalation ou contact cutané/yeux |
Méthodes de synthèse de l’amide de sodium
Diverses méthodes permettent de synthétiser l’azanide de sodium.
Une méthode courante est la réaction entre le sodium métallique et l’ammoniac gazeux (NH3) . Dans ce processus, le sodium métallique réagit avec l’ammoniac gazeux dans des conditions contrôlées pour produire de l’azanide de sodium. La réaction a généralement lieu dans une cuve réacteur équipée de mesures de sécurité appropriées.
Une autre méthode implique la réaction entre l’hydrure de sodium (NaH) et l’ammoniac gazeux. L’hydrure de sodium, un composé solide, réagit avec l’ammoniac gazeux pour produire de l’azanide de sodium et de l’hydrogène gazeux. Des atmosphères inertes sont souvent utilisées pour réaliser cette réaction afin d’éviter des réactions secondaires indésirables.
De plus, la réaction entre le sodium métallique et l’ammoniac liquide permet la préparation d’azanide de sodium. Cette méthode consiste à dissoudre le sodium métallique dans de l’ammoniac liquide, entraînant la formation d’azanide de sodium et d’hydrogène gazeux.
Pour synthétiser l’azanide de sodium, l’azoture de sodium (NaN3) réagit avec l’hydroxyde de sodium (NaOH). La réaction entre ces deux composés produit de l’azanide de sodium ainsi que la libération d’azote gazeux.
Il convient de noter que ces méthodes de synthèse nécessitent une expertise et des précautions de sécurité appropriées en raison de la réactivité et des dangers associés à l’azanide de sodium.
Utilisations de l’amide de sodium
L’azanide de sodium trouve des applications dans divers domaines en raison de ses propriétés uniques. Voici quelques-unes de ses utilisations :
- Base forte dans les réactions de chimie organique : L’azanide de sodium déprotonne les acides faibles, facilitant la synthèse de divers composés organiques.
- Source d’azote dans les réactions : l’azanide de sodium introduit des atomes d’azote dans les molécules organiques, jouant un rôle crucial dans la synthèse de produits pharmaceutiques, de colorants et de polymères.
- Déshydrohalogénation : l’azanide de sodium élimine les halogénures d’hydrogène des composés organiques dans les réactions de déshydrohalogénation. Ce processus facilite la préparation d’alcènes, d’alcynes et d’autres composés insaturés.
- Réactions d’ouverture de cycle : L’azanide de sodium participe aux réactions d’ouverture de cycle des composés cycliques, telles que la synthèse de Gabriel, convertissant les amines cycliques en amines primaires.
- Désulfuration : l’azanide de sodium peut éliminer les atomes de soufre des composés organiques, permettant ainsi des réactions de désulfuration. Ceci est utile dans la production de carburants sans soufre et dans la réduction de l’impact environnemental des composés contenant du soufre.
- Stockage de l’hydrogène : les chercheurs ont étudié l’utilisation potentielle de l’azanide de sodium dans les systèmes de stockage de l’hydrogène. Il peut réagir avec l’hydrogène gazeux, formant de l’hydrure de sodium, qui peut ensuite libérer de l’hydrogène lors du chauffage.
- Support de catalyseur : L’azanide de sodium peut agir comme support de catalyseur, améliorant les performances de certaines réactions catalytiques. Il assure la stabilité et améliore l’efficacité des catalyseurs dans diverses transformations chimiques.
Dans l’ensemble, les propriétés polyvalentes de l’azanide de sodium en font un composé précieux dans la synthèse organique, la chimie de l’azote et d’autres applications industrielles.
Des questions:
Q : Que fait NaNH2 ?
R : NaNH2 est une base forte couramment utilisée dans les réactions de chimie organique pour déprotoner les acides faibles et faciliter diverses transformations.
Q : Qu’est-ce que NaNH2 ?
R : NaNH2 est de l’amidure de sodium, un composé chimique constitué d’ions sodium (Na) et azanide (NH2), souvent utilisé comme réactif et base forte dans la synthèse organique.
Q : À quoi sert un excès de NaNH2 ?
R : Un excès de NaNH2 peut conduire à une déprotonation supplémentaire des atomes d’hydrogène acides dans une réaction, augmentant ainsi l’étendue de la déprotonation et modifiant potentiellement le résultat de la réaction.
Q : Que fait NaNH2 à un alcène ?
R : NaNH2 peut extraire un atome d’hydrogène d’un alcène, entraînant la formation d’un alcane et d’un composé alcoolate de sodium.
Q : Que fait NaNH2 au bromobenzène ?
R : NaNH2 peut remplacer l’atome de brome dans le bromobenzène grâce à une réaction de substitution nucléophile, entraînant la formation de phénylamine de sodium.
Q : NaNH2 est-il une base forte ?
R : Oui, NaNH2 est une base forte capable d’accepter des protons et de déprotoner les acides faibles en raison de la présence de l’ion amide.
Q : Quelle réaction aura lieu si H2O est ajouté à un mélange NaNH2/NH3 ?
R : L’ajout de H2O à un mélange de NaNH2/NH3 entraîne la génération d’ammoniac gazeux (NH3) et d’hydroxyde de sodium (NaOH) en raison de la réaction entre l’eau et la base forte NaNH2.
Q : Quel intermédiaire est impliqué dans cette réaction : NaNH2 + NH3 liquide ?
R : L’intermédiaire impliqué dans la réaction du NaNH2 avec le NH3 liquide est un électron solvaté, formé par le don d’un électron du sodium à l’ammoniac.
Q : NaNH2 est-il un bon nucléophile ?
R : Oui, NaNH2 peut agir comme un bon nucléophile en raison de sa capacité à donner une paire d’électrons et à participer à des réactions de substitution nucléophile.
Q : Le NaNH2 est-il ionique ou covalent ?
R : NaNH2 est un composé ionique composé d’ions sodium chargés positivement (Na+) et d’ions amide chargés négativement (NH2-).
Q : Le 2-hexyne réagira-t-il avec l’amide de sodium ?
R : Oui, le 2-hexyne peut subir une réaction avec l’amidure de sodium, entraînant la formation d’acétylure de sodium et du composé alcyne correspondant.
Q : Quelle est la base la plus forte parmi l’amidure de sodium et le phénoxate de sodium ?
R : L’azanide de sodium est la base plus forte que le phénoxate de sodium en raison de la plus grande basicité de l’ion amide (NH2-) par rapport à l’ion phénoxe (C6H5O-).
