L’acide sulfurique (H2SO4) ou huile de vitriol est un acide minéral hautement corrosif et fort couramment utilisé dans divers processus industriels tels que la production d’engrais, le raffinage du pétrole et le traitement des métaux. C’est également un puissant agent déshydratant.
| Nom UICPA | Acide sulfurique |
| Formule moléculaire | H2SO4 |
| Numero CAS | 7664-93-9 |
| Synonymes | Huile de vitriol, anhydride d’acide sulfurique, acide bisulfurique |
| InChI | InChI=1S/H2O4S/c2-1(3)4/h(H2,2,3,4)/p-1 |
Propriétés de l’acide sulfurique
Formule d’acide sulfurique
La formule chimique de l’acide sulfurique est H2SO4, qui représente deux atomes d’hydrogène, un atome de soufre et quatre atomes d’oxygène. Cette formule représente la composition de la molécule d’acide sulfurique et sa structure chimique.
Masse molaire de Acide Sulfurique
La masse molaire de l’acide sulfurique est de 98,08 g/mol. Il est calculé en additionnant les masses atomiques de chaque élément de la formule chimique de l’acide sulfurique (H2SO4).
Point d’ébullition de l’acide sulfurique
L’acide sulfurique a un point d’ébullition de 337,1°C. A cette température, la pression de vapeur du liquide atteint la pression atmosphérique et il commence à bouillir.
Point de fusion de l’acide sulfurique
Le point de fusion de l’acide sulfurique est de 10,4°C. C’est un liquide très visqueux à température ambiante, mais il peut geler pour former un état solide à des températures plus basses.
Densité de l’acide sulfurique g/ml
La densité de l’acide sulfurique varie de 1,84 g/mL à 1,93 g/mL, selon sa concentration. À mesure que la concentration d’acide sulfurique augmente, sa densité augmente également.
Poids moléculaire de l’acide sulfurique
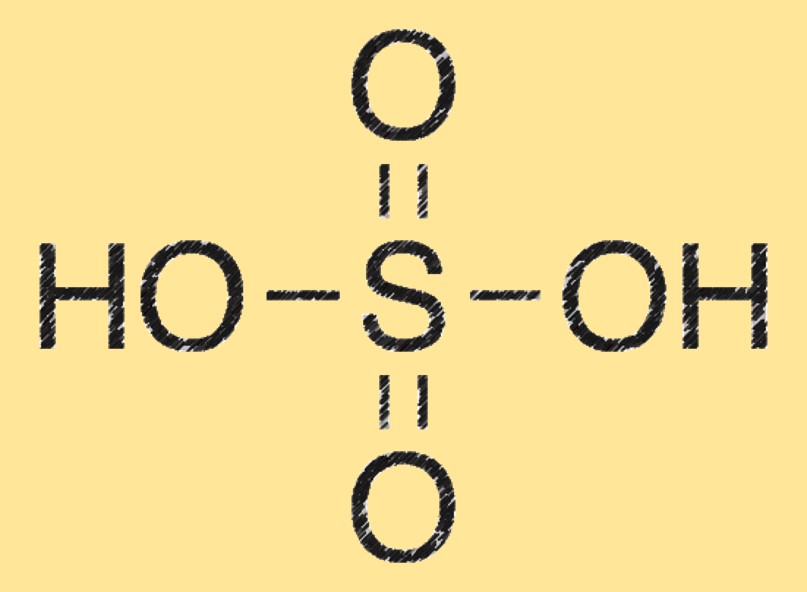
Le poids moléculaire de l’acide sulfurique est de 98,08 g/mol. Il est calculé en additionnant les masses atomiques de chaque élément dans sa formule chimique (H2SO4).
Structure de l’acide sulfurique
La molécule d’acide sulfurique est constituée de deux atomes d’hydrogène (H) liés à un atome de soufre (S) également lié à quatre atomes d’oxygène (O). Il a une géométrie moléculaire tétraédrique et est un puissant agent déshydratant.
| Apparence | Liquide clair, incolore et huileux |
| Gravité spécifique | 1,84 (eau = 1) |
| Couleur | Incolore |
| Odeur | Odeur âcre et sulfureuse |
| Masse molaire | 98,079 g/mole |
| Densité | 1,835 g/mL |
| Point de fusion | 10,5°C |
| Point d’ébullition | 337°C |
| Point d’éclair | 140°F (60°C) |
| Solubilité dans l’eau | Complètement miscible |
| Solubilité | Soluble dans l’eau et l’alcool |
| Pression de vapeur | 40 mmHg (20 °C) |
| Densité de vapeur | 2,5 (air = 1) |
| pKa | -3 |
| pH | Moins de 1 (fortement acide) |
Sécurité et dangers de l’acide sulfurique
L’acide sulfurique est une substance hautement corrosive et dangereuse. Le contact avec la peau et les yeux peut provoquer de graves brûlures et la cécité. L’inhalation de ses vapeurs peut irriter le système respiratoire et provoquer de la toux, une respiration sifflante et un essoufflement. Il est inflammable et réactif et doit être manipulé avec prudence dans un endroit bien ventilé, en utilisant un équipement de protection tel que des gants et des lunettes de protection. Les déversements doivent être nettoyés immédiatement pour éviter d’endommager les surfaces et de nuire potentiellement aux personnes. Un stockage et un étiquetage appropriés sont nécessaires pour garantir une manipulation sûre.
| Symboles de danger | Corrosif, Irritant, Nocif |
| Description de la sécurité | Tenir à l’écart de la chaleur/des étincelles/des flammes nues/des surfaces chaudes. Interdiction de fumer. Conserver dans un endroit bien ventilé. Gardez le récipient bien fermé. Porter des gants de protection/des vêtements de protection/un équipement de protection des yeux/du visage. |
| Numéros d’identification de l’ONU | UN1830 |
| Code SH | 2815.11.00 |
| Classe de danger | 8 |
| Groupe d’emballage | II |
| Toxicité | Orale : DL50 = 1,2 g/kg (Rat) |
Méthodes de synthèse de l’acide sulfurique
Le H2SO4 peut être synthétisé par plusieurs méthodes, notamment le processus de contact et le processus de chambre principale.
Le procédé de contact est la méthode la plus largement utilisée pour la production industrielle d’acide sulfurique, qui implique l’oxydation du dioxyde de soufre en trioxyde de soufre, puis la réaction du trioxyde de soufre avec l’eau pour produire du H2SO4.
Le procédé en chambre de plomb, quant à lui, implique l’oxydation du dioxyde de soufre avec du dioxyde d’azote en présence d’un catalyseur, généralement du dioxyde de plomb, puis la réaction du trioxyde de soufre résultant avec de l’eau. Les deux méthodes produisent du H2SO4 avec différents niveaux de pureté et de concentration, qui peut être davantage purifié et concentré selon les besoins.
Utilisations de l’acide sulfurique
Le H2SO4 est un produit chimique polyvalent et largement utilisé dans diverses industries. Les gens utilisent couramment l’acide sulfurique dans la production d’engrais, de détergents, de colorants et de pigments. Elle joue également un rôle dans le raffinage des produits pétroliers, la transformation des minéraux et des minerais et la production de produits chimiques tels que l’acide nitrique et les sulfates. Les laboratoires utilisent le H2SO4 comme réactif et sert de catalyseur dans les réactions chimiques. Les batteries au plomb utilisent de l’acide sulfurique comme électrolyte, et les sidérurgistes l’utilisent pour le décapage afin d’éliminer la rouille et le tartre avant le placage ou la peinture.
Dans l’ensemble, le H2SO4 joue un rôle crucial dans de nombreux processus industriels, ce qui en fait l’un des produits chimiques les plus importants au monde.
Des questions:
L’acide sulfurique est-il un acide fort ?
Oui, H2SO4 est un acide fort. Un acide fort est un acide qui se dissocie complètement dans l’eau pour produire des ions hydrogène (H+), ce qui signifie qu’il donne tous ses ions hydrogène à la solution. Considéré comme l’un des acides les plus forts, l’acide sulfurique possède un niveau d’acidité élevé, ce qui le rend très réactif et corrosif. Pour éviter tout dommage aux personnes et à l’environnement, une manipulation et un stockage appropriés de l’acide sulfurique sont indispensables.
A quoi sert l’acide sulfurique ?
L’acide sulfurique est largement utilisé dans diverses industries et applications. Certaines des utilisations les plus courantes du H2SO4 comprennent :
- Production d’engrais : l’acide sulfurique est utilisé dans la production d’acide phosphorique, qui est un composant clé de nombreux engrais.
- Raffinage du pétrole : l’acide sulfurique est utilisé pour éliminer les impuretés telles que les composés soufrés du pétrole brut pendant le processus de raffinage.
- Traitement des métaux : l’acide sulfurique est utilisé dans le traitement des métaux pour éliminer la rouille et le tartre du fer et de l’acier, ainsi que pour raffiner les minerais métalliques.
- Fabrication : l’acide sulfurique est utilisé dans la production d’une variété de produits, notamment des détergents, des colorants, des pigments et d’autres produits chimiques.
- Batteries automobiles : l’acide sulfurique est utilisé comme électrolyte dans les batteries au plomb, couramment utilisées dans les voitures et autres véhicules.
- Réactif de laboratoire : l’acide sulfurique est couramment utilisé comme réactif de laboratoire en raison de son niveau élevé de réactivité et de sa capacité à dissoudre de nombreuses substances.
Quel type d’acide est l’acide sulfurique ?
H2SO4 est un acide inorganique fort. Classé comme acide diprotique, H2SO4 donne deux ions hydrogène (H+) à une solution, ce qui en fait un acide minéral fort. En raison de sa nature hautement réactive et corrosive, des précautions doivent être prises lors de la manipulation et du stockage du H2SO4 afin d’éviter tout dommage aux personnes et à l’environnement. Les industries utilisent largement l’acide sulfurique dans leurs processus, notamment dans la production d’engrais, de détergents, de colorants, de pigments et d’autres produits chimiques, ainsi que dans le raffinage des produits pétroliers et le traitement des minerais métalliques.
Quelle est la formule de l’acide sulfurique ?
La formule chimique de l’acide sulfurique est H2SO4.
Qu’est-ce que l’huile de vitriol ?
L’huile de vitriol est un autre terme désignant l’acide sulfurique, un produit chimique puissant et hautement corrosif. Il est couramment utilisé dans la production d’engrais, de détergents et de colorants, ainsi que dans le raffinage du pétrole et le traitement d’autres produits chimiques.
