L’acide propanoïque ou C3H6O2 est un acide carboxylique liquide incolore avec une odeur âcre. Il est utilisé, entre autres, dans la production de produits pharmaceutiques, d’herbicides et de conservateurs alimentaires.
| Nom UICPA | Acide propanoïque |
| Formule moléculaire | C3H6O2 |
| Numero CAS | 79-09-4 |
| Synonymes | Acide propionique, acide méthylacétique, acide éthylformique, acide propanylformique, solution d’acide propionique, etc. |
| InChI | InChI=1S/C3H6O2/c1-2-3(4)5/h2H2,1H3,(H,4,5) |
Structure de l’acide propanoïque
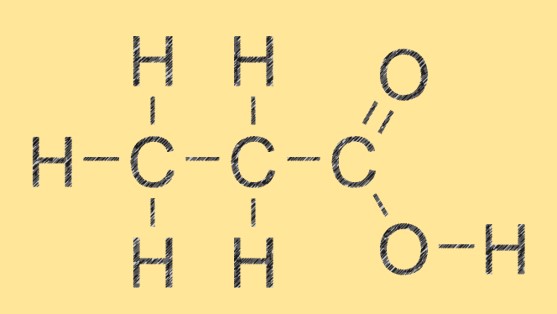
L’acide propanoïque a une structure linéaire simple composée de trois atomes de carbone, six atomes d’hydrogène et deux atomes d’oxygène. Le groupe acide carboxylique (-COOH) est attaché au deuxième atome de carbone de la molécule. Cette structure permet à l’acide propanoïque de former de fortes liaisons hydrogène avec d’autres molécules d’acide propanoïque et avec d’autres composés possédant des accepteurs ou des donneurs de liaisons hydrogène.
Point d’ébullition de l’acide propanoïque
Le point d’ébullition de l’acide propanoïque est de 141,1 °C. Cette valeur est influencée par les forces intermoléculaires présentes dans le composé. L’acide propanoïque a un point d’ébullition relativement élevé par rapport aux autres acides carboxyliques simples en raison de sa capacité à former de fortes liaisons hydrogène. Cette propriété fait de l’acide propanoïque un solvant utile en chimie organique.
Formule d’acide propanoïque
La formule chimique de l’acide propanoïque est C3H6O2. Cette formule représente le nombre exact et le type d’atomes dans une seule molécule d’acide propanoïque. La formule peut être utilisée pour calculer la masse molaire, le poids moléculaire et les rapports stœchiométriques dans les réactions chimiques impliquant l’acide propanoïque.
Masse molaire de l’acide propionique
L’acide propionique a une masse molaire de 74,08 g/mol. C’est un acide carboxylique organique simple avec trois atomes de carbone, six atomes d’hydrogène et deux atomes d’oxygène. La masse molaire est un paramètre important en chimie car elle est utilisée pour déterminer la quantité de substance dans un échantillon donné. Il est également utilisé dans les calculs stœchiométriques pour déterminer la quantité de réactif ou de produit dans une réaction chimique.
Point de fusion de l’acide propionique
L’acide propionique a un point de fusion de -20,8 °C. Ce faible point de fusion est le résultat des faibles forces intermoléculaires présentes dans le composé. L’acide propionique est liquide à température ambiante et peut facilement se solidifier à basse température.
Densité de l’acide propionique g/ml
L’acide propionique a une densité de 0,99 g/mL à température ambiante. Cette propriété est influencée par le poids moléculaire et la densité de tassement des molécules du composé. La densité de l’acide propionique le rend moins dense que l’eau, lui permettant de flotter à la surface de l’eau.
Poids moléculaire de l’acide propionique
Le poids moléculaire de l’acide propionique est de 74,08 g/mol. Cette valeur est calculée en additionnant les poids atomiques des atomes constitutifs de la molécule. Le poids moléculaire de l’acide propionique est utilisé pour déterminer la masse molaire et le nombre de moles du composé dans un échantillon donné.
| Apparence | Liquide incolore |
| Gravité spécifique | 0,99 g/ml |
| Couleur | Incolore |
| Odeur | Âcre |
| Masse molaire | 74,08 g/mole |
| Densité | 0,99 g/ml |
| Point de fusion | -20,8 °C |
| Point d’ébullition | 141,1 °C |
| Point d’éclair | 60 °C |
| Solubilité dans l’eau | Miscible |
| Solubilité | Soluble dans l’éthanol, l’éther, l’acétone |
| Pression de vapeur | 1,5 mmHg à 25 °C |
| Densité de vapeur | 2,5 (contre l’air) |
| pKa | 4,87 |
| pH | 2,8 (solution 1M) |
Remarque : Les valeurs fournies dans le tableau sont approximatives et peuvent varier selon la source des données.
Acide propanoïque Sécurité et dangers
Une mauvaise manipulation de l’acide propanoïque peut présenter des risques pour la sécurité et la santé. Cette substance est corrosive et peut provoquer de graves irritations de la peau et des yeux, ainsi que des problèmes respiratoires en cas d’inhalation. De plus, l’acide propanoïque est inflammable et peut former des mélanges explosifs avec l’air. Pour garantir la sécurité, stockez-le dans un endroit frais, sec et bien ventilé, loin des sources de chaleur, des étincelles ou des flammes. Lors de la manipulation de cette substance, portez des équipements de protection tels que des gants, des lunettes et des masques respiratoires pour éviter tout contact avec la peau et les yeux ou l’inhalation de vapeurs. Consulter immédiatement un médecin en cas d’ingestion ou de contact avec la peau et les yeux.
| Symboles de danger | Corrosif (C) |
| Description de la sécurité | S26-S36/37/39-S45 |
| Identifiants ONU | ONU 1848 |
| Code SH | 2915.90.10 |
| Classe de danger | 8 (Matériau corrosif) |
| Groupe d’emballage | III |
| Toxicité | DL50 (orale, rat) = 1,26 g/kg |
Méthodes de synthèse de l’acide propanoïque
L’acide propionique peut être synthétisé par plusieurs méthodes. Une méthode courante est l’oxydation du propylène, qui consiste à faire réagir le propylène avec de l’air en présence d’un catalyseur, généralement un oxyde métallique, pour former de l’acroléine. L’acroléine est ensuite oxydée pour former de l’acide acrylique, qui est ensuite converti en acide propionique par une réaction de décarboxylation.
Une autre méthode implique la carboxylation de l’éthylène, qui consiste à faire réagir l’éthylène avec du dioxyde de carbone et de l’eau en présence d’un catalyseur, généralement un sel métallique ou un complexe de palladium, pour former de l’acétaldéhyde. L’acétaldéhyde est ensuite oxydé en acide acétique, qui est ensuite converti en acide propanoïque par une réaction de décarboxylation.
Une troisième méthode implique l’hydrolyse du cyanure d’éthyle, qui consiste à faire réagir le cyanure d’éthyle avec de l’eau en présence d’un acide ou d’une base forte pour former de l’acide propionique.
Une quatrième méthode implique la fermentation des glucides, qui implique l’utilisation de bactéries telles que Propionibacterium freudenreichii pour convertir les sucres en acide propionique. Cette méthode est couramment utilisée dans l’industrie alimentaire pour produire de l’acide propionique destiné à être utilisé comme conservateur.
Dans l’ensemble, ces méthodes offrent diverses options pour la synthèse de l’acide propionique, en fonction de la pureté, du rendement et de l’impact environnemental souhaités.
Utilisations de l’acide propanoïque
- L’industrie alimentaire utilise l’acide propanoïque comme conservateur pour empêcher la croissance de bactéries et de moisissures dans les produits de boulangerie, les produits laitiers et les aliments pour animaux.
- L’acide propionique sert d’intermédiaire chimique dans la production d’autres produits chimiques, notamment les esters utilisés dans la production de parfums, d’arômes et de plastiques.
- L’anhydride propionique, produit à partir de l’acide propanoïque, est utilisé comme solvant et réactif en synthèse organique.
- L’industrie pharmaceutique utilise l’acide propanoïque comme matière première dans la synthèse de médicaments tels que l’ibuprofène, le naproxène et le fénoprofène.
- L’acide propionique est également utilisé dans la production d’herbicides et d’insecticides.
- L’acétate propionate de cellulose, un revêtement pour produits pharmaceutiques et un composant des peintures, vernis et revêtements, est produit à partir d’acide propionique.
Dans l’ensemble, l’acide propionique a une large gamme d’applications en raison de ses propriétés antibactériennes et conservatrices, ainsi que de sa polyvalence en tant qu’intermédiaire chimique.
Des questions:
Quel composé peut-on prédire qu’il aura des propriétés chimiques similaires à celles de l’acide propanoïque (ch3ch2cooh) ?
L’acide propionique (CH3CH2COOH) prédit que les composés ayant une structure chimique similaire auront des propriétés chimiques comparables. L’acide butanoïque (CH3CH2CH2COOH) est un composé avec une structure similaire à l’acide propionique, avec un groupe méthylène ajouté dans la chaîne carbonée. Ce groupe méthylène supplémentaire devrait affecter la polarité et l’acidité de la molécule, mais les deux composés ont des caractéristiques analogues, par exemple être des acides organiques faibles.
L’industrie alimentaire utilise l’acide butanoïque comme conservateur et sert d’intermédiaire chimique dans la production d’esters, de solvants et de produits pharmaceutiques, similaires à l’acide propanoïque. L’acide butanoïque peut également remplacer l’acide propionique dans certaines applications car il a une valeur pKa proche.
L’acide propanoïque est-il un acide fort ?
L’acide propanoïque est un acide faible. Son pKa est d’environ 4,87, ce qui indique qu’il ne cède pas facilement un proton à une base lors d’une réaction chimique.
En comparaison, les acides forts tels que l’acide chlorhydrique (HCl) et l’acide sulfurique (H2SO4) ont des valeurs de pKa beaucoup plus faibles et donnent facilement des protons dans les réactions chimiques. Bien qu’il s’agisse d’un acide faible, l’acide propionique reste utile dans certaines applications. Sa faible acidité le rend approprié comme conservateur dans l’industrie alimentaire, car il est efficace pour inhiber la croissance des bactéries et des champignons sans affecter le goût ou l’odeur des produits alimentaires.
