L’acide phosphorique (H3PO4) est un acide minéral incolore et inodore. Il est largement utilisé dans l’industrie alimentaire et des boissons comme agent aromatisant et comme inhibiteur de rouille dans l’industrie automobile.
| Nom UICPA | Acide phosphorique |
| Formule moléculaire | H3PO4 |
| Numero CAS | 7664-38-2 |
| Synonymes | Acide orthophosphorique, trihydroxydooxydophosphore, acide phosphorique (V), acide orthophosphorique, technologie claire d’acide phosphorique, phosphorsaeure |
| InChI | InChI=1S/H3O4P/c1-5(2,3)4/h(H3,1,2,3,4) |
Propriétés de l’acide phosphorique
Masse molaire de l’acide phosphorique
La masse molaire de l’acide phosphorique est de 98,00 g/mol. Cette valeur est calculée en additionnant les masses atomiques de chacun des atomes constitutifs de la molécule, qui sont un atome de phosphore et trois atomes d’oxygène. La masse molaire est une propriété importante d’un composé, car elle est utilisée pour calculer la quantité de substance présente dans un échantillon donné à l’aide du nombre d’Avogadro. De plus, la masse molaire de l’acide phosphorique est utilisée pour déterminer la concentration d’une solution par titrage.
Formule d’acide phosphorique
La formule chimique de l’acide phosphorique est H3PO4, ce qui indique qu’il contient un atome de phosphore, trois atomes d’hydrogène et quatre atomes d’oxygène. C’est un acide faible qui peut donner jusqu’à trois ions hydrogène à une base. La formule est importante car elle nous permet d’écrire des équations chimiques et de calculer la stœchiométrie des réactions chimiques impliquant l’acide phosphorique. De plus, la formule est utilisée pour calculer la concentration d’une solution d’acide phosphorique par titrage.
Point d’ébullition de l’acide phosphorique
Le point d’ébullition de l’acide phosphorique est de 158°C (316°F) à 1 atmosphère de pression. Cela signifie qu’à cette température et pression, la phase liquide de l’acide phosphorique se transformera en phase gazeuse. Le point d’ébullition dépend des forces intermoléculaires présentes dans le composé et, dans le cas de l’acide phosphorique, il est dû à la présence de liaisons hydrogène entre les molécules. Le point d’ébullition est une propriété physique importante d’un composé, car il est utilisé pour déterminer sa volatilité, ce qui est utile dans de nombreux processus industriels.
Point de fusion de l’acide phosphorique
Le point de fusion de l’acide phosphorique est de 42,35°C (108,23°F). C’est la température à laquelle la phase solide de l’acide phosphorique se transformera en phase liquide. Le point de fusion dépend de la force des forces intermoléculaires présentes dans le composé et, dans le cas de l’acide phosphorique, il est dû à la présence de liaisons hydrogène entre les molécules. Le point de fusion est une propriété physique importante d’un composé, car il est utilisé pour déterminer sa pureté et établir son identité.
Densité de l’acide phosphorique g/ml
La densité de l’acide phosphorique est de 1,685 g/ml à température ambiante (25°C ou 77°F). Il s’agit de la masse de la substance par unité de volume. La densité est une propriété physique d’une substance et elle est utilisée pour calculer le volume d’une masse donnée de la substance ou la masse d’un volume donné de la substance. La densité de l’acide phosphorique est importante dans de nombreux processus industriels, notamment la production d’engrais, de détergents et d’additifs alimentaires.
Poids moléculaire de l’acide phosphorique
Le poids moléculaire de l’acide phosphorique est de 98,00 g/mol. C’est la somme des poids atomiques de tous les atomes de la molécule. Le poids moléculaire est une propriété importante d’un composé, car il est utilisé pour calculer la quantité de substance présente dans un échantillon donné. De plus, le poids moléculaire de l’acide phosphorique est utilisé pour déterminer la concentration d’une solution par titrage.
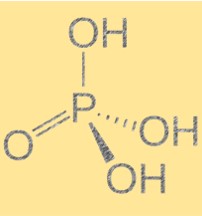
Structure de l’acide phosphorique (H3PO4)
L’acide phosphorique a une formule moléculaire de H3PO4 et une géométrie moléculaire tétraédrique. C’est un acide triprotique, ce qui signifie qu’il peut donner trois ions hydrogène à une base. La molécule contient un atome de phosphore lié à quatre atomes d’oxygène, dont trois sont liés à des atomes d’hydrogène. La structure de l’acide phosphorique est importante car elle détermine ses propriétés chimiques et physiques. La présence de liaisons hydrogène entre les molécules donne lieu à des points d’ébullition et de fusion élevés.
| Apparence | Liquide incolore |
| Gravité spécifique | 1,685 à 25°C |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 98,00 g/mole |
| Densité | 1,685 g/ml à 25°C |
| Point de fusion | 42,35°C (108,23°F) |
| Point d’ébullition | 158 °C (316 °F) à une pression de 1 atm |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Complètement soluble dans l’eau |
| Solubilité | Soluble dans l’éthanol, l’éther diéthylique et l’acétone |
| Pression de vapeur | 0,0002 mmHg à 20°C |
| Densité de vapeur | 3,5 (air = 1) |
| pKa | pKa1=2,148, pKa2=7,198, pKa3=12,319 |
| pH | 1,0 – 2,5 (solution concentrée), 2,8 – 3,2 (solution diluée) |
H3PO4 Sécurité et dangers
L’acide phosphorique présente plusieurs risques pour la sécurité et doit être manipulé avec précaution. Il peut provoquer de graves irritations de la peau et des yeux et est très corrosif pour les métaux. Le contact direct avec la peau, les yeux ou les muqueuses peut provoquer de graves brûlures, voire des dommages permanents. L’inhalation des fumées peut provoquer une irritation des voies respiratoires et des brûlures. Il ne doit pas être ingéré car il peut provoquer de graves brûlures internes et des troubles gastro-intestinaux. Lors de la manipulation de l’acide phosphorique, un équipement de protection individuelle approprié tel que des gants, des lunettes et un respirateur doit être porté. Il doit également être stocké dans un endroit frais et sec, à l’écart des matières incompatibles telles que les agents oxydants et les alcalis.
| Symboles de danger | Corrosif |
| Description de la sécurité | Gardez le récipient bien fermé. Porter des gants de protection/des vêtements de protection/un équipement de protection des yeux/du visage. |
| Numéros d’identification de l’ONU | UN1805 |
| Code SH | 280920 |
| Classe de danger | 8 (Substances corrosives) |
| Groupe d’emballage | II (danger moyen) |
| Toxicité | DL50 orale (rat) – 1533 mg/kg |
Méthodes de synthèse H3PO4
Plusieurs méthodes existent pour synthétiser l’acide phosphorique (H3PO4).
La méthode la plus courante est le procédé humide qui implique la réaction du phosphate naturel avec l’acide sulfurique . Pour produire du sulfate de calcium (gypse) et du H3PO4, la roche phosphatée est d’abord broyée puis mélangée à de l’acide sulfurique concentré. Après avoir filtré la suspension résultante, la série d’étapes d’extraction par solvant et de précipitation purifie le H3PO4.
Une autre méthode de synthèse du H3PO4 est le processus thermique qui consiste à chauffer la roche phosphatée à une température élevée pour produire du H3PO4 et d’autres sous-produits tels que le phosphore élémentaire et l’oxyde de calcium. Cette méthode est moins courante que le procédé humide en raison de ses besoins énergétiques élevés.
La réaction du pentoxyde de phosphore avec l’eau synthétise H3PO4. Les industries de l’électronique et des semi-conducteurs utilisent couramment cette méthode pour produire du H3PO4 de haute pureté.
D’autres méthodes de synthèse de H3PO4 comprennent l’oxydation électrochimique du phosphore, l’hydrolyse du trichlorure de phosphore et la réaction du phosphore avec l’acide nitrique . Ces méthodes sont moins courantes que les procédés humides et thermiques en raison de leur coût et de leur complexité élevés.
Utilisations de H3PO4
L’acide phosphorique est un composé polyvalent qui a un large éventail d’applications dans diverses industries. Certaines de ses principales utilisations sont :
- Production d’engrais : composant principal de la production d’engrais tels que le phosphate diammonique et le superphosphate triple.
- Industrie alimentaire et des boissons : utilisé comme additif alimentaire et agent aromatisant dans divers produits alimentaires et boissons tels que les boissons au cola, les confitures et le fromage fondu.
- Nettoyage industriel : Utilisé comme nettoyant et antirouille dans le secteur industriel en raison de sa capacité à dissoudre la rouille et autres dépôts minéraux.
- Traitement de l’eau : Utilisé pour contrôler les niveaux de pH de l’eau dans les processus industriels et également pour éliminer les métaux lourds et autres impuretés.
- Produits pharmaceutiques : Utilisé dans la production de produits pharmaceutiques et de compléments alimentaires en raison de sa capacité à réguler les niveaux de pH.
- Dentisterie : utilisé dans les procédures dentaires telles que le traitement du canal radiculaire et comme composant du ciment dentaire.
- Traitement des métaux : utilisé pour traiter et passiver les métaux tels que l’acier inoxydable, l’aluminium et le titane afin d’améliorer leur résistance à la corrosion.
- Electronique : Utilisé dans l’industrie électronique comme agent de nettoyage et comme composant dans la production de semi-conducteurs.
Des questions:
Q : Quelle est la formule de l’acide phosphorique ?
R : La formule de l’acide phosphorique est H3PO4.
Q : Le H3PO4 est-il un acide fort ?
R : Non, le H3PO4 n’est pas considéré comme un acide fort. C’est un acide faible avec une valeur pKa de 2,15.
Q : H3PO4 est-il un acide ou une base ?
R : H3PO4 est un acide car il donne un proton (H+) lorsqu’il est dissous dans l’eau.
Q : Quelle est la structure de Lewis pour H3PO4 ?
R : La structure de Lewis pour H3PO4 est une structure tétraédrique avec un atome central de phosphore entouré de quatre atomes d’oxygène. Chaque atome d’oxygène forme une liaison simple avec l’atome de phosphore, et il y a également trois paires d’électrons libres sur chaque atome d’oxygène.
Q : L’acide phosphorique est-il un acide fort ? R : Non, l’acide phosphorique n’est pas considéré comme un acide fort. C’est un acide faible avec une valeur pKa de 2,15 pour le premier don de protons et de 7,20 pour le deuxième don de protons.
