L’acide nitrique (HNO3) est un acide inorganique fort et hautement réactif. Il est utilisé dans les engrais, les explosifs et dans l’industrie de la teinture et de l’impression textile. Il forme également des nitrates, qui jouent un rôle important dans les processus biologiques et les réactions de combustion.
| Nom UICPA | Acide nitrique |
| Formule moléculaire | HNO3 |
| Numero CAS | 7697-37-2 |
| Synonymes | Aqua fortis, Esprit de nitre, Acide nitreux |
| InChI | InChI=1S/HNO3/c2-1(3)4 |
Propriétés de l’acide nitrique
Acide Nitrique Masse molaire
La masse molaire de l’acide nitrique est de 63,01 g/mol. C’est la quantité de substance qui contient le même nombre d’entités (telles que des atomes, des molécules ou des ions) que dans 12 grammes de carbone 12 pur.
Formule d’acide nitrique
La formule chimique de l’acide nitrique est HNO<sub>3</sub>. Il représente le nombre et le type d’atomes dans la molécule. La formule peut être utilisée pour prédire ses propriétés physiques et chimiques, telles que le point d’ébullition, le point de fusion et la densité.
Point d’ébullition de l’acide nitrique
Le point d’ébullition de l’acide nitrique est de 83,0 °C (181,4 °F). C’est la température à laquelle une substance passe de l’état liquide à l’état gazeux à une pression donnée. L’acide nitrique est une substance hautement réactive et volatile, et le point d’ébullition aide à déterminer les conditions dans lesquelles il doit être manipulé et stocké.
Point de fusion de l’acide nitrique
Le point de fusion de l’acide nitrique est de -41,5 °C (-42,7 °F). C’est la température à laquelle une substance solide change d’état en liquide. Le faible point de fusion de l’acide nitrique le rend facile à manipuler sous sa forme liquide.
Densité d’acide nitrique g/ml
La densité de l’acide nitrique est de 1,51 g/mL. C’est une mesure de la quantité de masse par unité de volume d’une substance. La densité de l’acide nitrique peut aider à déterminer ses exigences en matière de stockage et de manipulation, ainsi que son potentiel de réaction avec d’autres substances.
Acide Nitrique Poids moléculaire
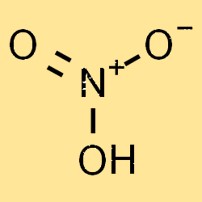
Le poids moléculaire de l’acide nitrique est de 63,01 g/mol. C’est la somme des poids atomiques des atomes individuels de la molécule. Le poids moléculaire de l’acide nitrique est un facteur important pour déterminer ses propriétés physiques et chimiques.
Structure de l’acide nitrique
L’acide nitrique est un liquide incolore, hautement réactif et volatil. Sa structure moléculaire se compose d’un atome d’azote, d’un atome d’hydrogène et de trois atomes d’oxygène, formant la formule chimique HNO3. Les atomes d’oxygène sont disposés selon une disposition planaire trigonale autour de l’atome d’azote.
| Apparence | Liquide incolore |
| Gravité spécifique | 1,51 g/ml |
| Couleur | Incolore |
| Odeur | Odeur âcre et âcre |
| Masse molaire | 63,01 g/mole |
| Densité | 1,51 g/ml |
| Point de fusion | -41,5 °C (-42,7 °F) |
| Point d’ébullition | 83,0 °C (181,4 °F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Miscible |
| Solubilité | Soluble dans l’alcool, l’éther et d’autres solvants polaires |
| La pression de vapeur | Élevé à température ambiante |
| Densité de vapeur | 1,48 (air = 1) |
| pKa | -1,3 |
| pH | 1 (solution à 10%) |
Remarque : Le point d’éclair de l’acide nitrique n’est pas applicable car il s’agit d’un liquide. Le pH d’une solution à 10 % d’acide nitrique est de 1, ce qui indique qu’il s’agit d’un acide fort. Le pKa est le logarithme négatif de la constante de dissociation acide, qui est une mesure de la force d’un acide en solution.
Sécurité et dangers de l’acide nitrique
L’acide nitrique est une substance hautement réactive et corrosive qui peut provoquer des blessures graves, voire la mort, si elle n’est pas manipulée correctement. Cela peut provoquer des brûlures, des lésions oculaires et une irritation respiratoire. Un équipement de protection approprié, tel que des gants et des lunettes, doit être porté lors de la manipulation de l’acide nitrique. Les zones de stockage doivent être bien ventilées et les déversements doivent être rapidement nettoyés pour éviter le dégagement de vapeurs toxiques. En cas de contact avec la peau ou les yeux, rincez la zone affectée avec de l’eau pendant au moins 20 minutes et consultez immédiatement un médecin.
| Symboles de danger | Dangereux pour l’environnement, Comburant, Nocif, Irritant |
| Description de la sécurité | S2 – Tenir hors de portée des enfants. S23 – Ne pas respirer les fumées. S24/25 – Éviter tout contact avec la peau et les yeux. S26 – En cas de contact avec les yeux, rincer immédiatement et abondamment à l’eau et consulter un médecin. |
| Numéros d’identification de l’ONU | ONU 2031 |
| Code SH | 2811.90.90 |
| Classe de danger | 8 |
| Groupe d’emballage | III |
| Toxicité | Très toxique par ingestion et inhalation. Peut provoquer de graves brûlures et lésions oculaires, ainsi qu’une irritation respiratoire. |
Méthodes de synthèse de l’acide nitrique
L’acide nitrique peut être synthétisé par plusieurs méthodes, notamment :
- Procédé Ostwald : Cette méthode implique l’oxydation de l’ammoniac avec de l’air pour former de l’oxyde nitrique, qui est ensuite oxydé en acide nitrique.
- Nitration du toluène : Cette méthode implique la nitration du toluène pour former du nitro-toluène, qui est ensuite oxydé pour former de l’acide nitrique.
- Décomposition thermique du nitrate d’ammonium : Cette méthode consiste à chauffer le nitrate d’ammonium pour produire de l’oxyde nitrique, qui est ensuite oxydé pour former de l’acide nitrique.
- Oxydation directe de l’ammoniac : Cette méthode implique l’oxydation directe de l’ammoniac avec de l’oxygène pour produire de l’acide nitrique.
- Électrolyse du nitrate de sodium : Cette méthode implique l’électrolyse du nitrate de sodium pour produire de l’acide nitrique.
Ces méthodes varient en termes d’efficacité, de coût et d’impact environnemental, et le choix de la méthode dépend de l’utilisation finale souhaitée et de l’échelle de production.
Utilisations de l’acide nitrique
L’acide nitrique a un large éventail d’utilisations dans diverses industries, notamment :
- Engrais : L’acide nitrique est utilisé dans la production d’engrais azotés, tels que le nitrate d’ammonium et les sels d’acide nitrique.
- Produits pharmaceutiques : L’acide nitrique est utilisé comme réactif dans la production de produits pharmaceutiques et d’autres intermédiaires chimiques.
- Explosifs : L’acide nitrique est utilisé dans la production d’explosifs, tels que la dynamite et la nitrocellulose.
- Traitement des métaux : l’acide nitrique est utilisé pour le décapage, le nettoyage et la gravure des métaux, notamment l’acier, le cuivre et l’aluminium.
- Teinture et impression : utilisé comme mordant dans les processus de teinture et d’impression.
- Traitement de l’eau : L’acide nitrique est utilisé dans le traitement de l’eau pour contrôler les niveaux de pH et éliminer les impuretés.
- Recherche et développement : L’acide nitrique est utilisé comme réactif de laboratoire pour diverses réactions et analyses chimiques.
Dans l’ensemble, l’acide nitrique a une gamme polyvalente d’applications en raison de ses propriétés acides et oxydantes, ce qui en fait un produit chimique crucial dans divers processus industriels.
Des questions:
L’acide nitrique est-il un acide fort ou un acide faible ?
Oui, l’acide nitrique (HNO3) est considéré comme un acide fort. Les acides forts se dissocient complètement dans l’eau pour produire des ions hydrogène (H+), ce qui signifie qu’ils s’ionisent complètement. En revanche, les acides faibles ne s’ionisent que partiellement dans l’eau, ce qui signifie qu’ils ne se dissocient pas complètement.
Dans une solution d’acide nitrique, presque toutes les molécules auront donné un ion hydrogène, ce qui en fera un puissant donneur de protons. En conséquence, l’acide nitrique a une concentration élevée d’ions hydrogène et un pH faible, généralement autour de 1-2. La force d’un acide est déterminée par sa capacité à donner des ions hydrogène et l’acide nitrique est l’un des acides les plus forts de la liste des acides forts.
Notez que l’acide nitrique (HNO3) exerce un fort effet oxydant et présente un risque de brûlures graves et de réactions chimiques. Manipulez l’acide nitrique avec prudence et portez un équipement de protection approprié.
