L’acide lactique est produit par les muscles lors d’un exercice intense, provoquant de la fatigue. On le trouve également dans les aliments fermentés comme le yaourt et est utilisé dans les produits de soin de la peau pour l’exfoliation.
| Nom UICPA | Acide 2-hydroxypropanoïque |
| Formule moléculaire | C3H6O3 |
| Numero CAS | 50-21-5 |
| Synonymes | Acide de lait, acide 2-hydroxypropionique, acide DL-lactique |
| InChI | InChI=1S/C3H6O3/c1-2(4)3(5)6/h2,4H,1H3,(H,5,6) |
Propriétés de l’acide lactique
Formule d’acide lactique
La formule chimique de l’acide du lait est C3H6O3. Il se compose de trois atomes de carbone, six atomes d’hydrogène et trois atomes d’oxygène. Cette formule représente la disposition et les types d’atomes présents dans une molécule d’acide du lait.
Acide Lactique Masse molaire
La masse molaire de l’acide du lait est d’environ 90,08 grammes par mole. Il est calculé en additionnant les masses atomiques de tous les atomes présents dans une molécule d’acide du lait.
Point d’ébullition de l’acide lactique
L’acide lactique a un point d’ébullition d’environ 122 à 135 degrés Celsius. A cette température, l’acide du lait passe de l’état liquide à l’état gazeux. Le point d’ébullition peut varier en fonction de la pureté et de la concentration de l’acide du lait.
Point de fusion de l’acide lactique
Le point de fusion de l’acide du lait est d’environ 17 à 18 degrés Celsius. À cette température, l’acide du lait subit un changement de phase de l’état solide à l’état liquide. Le point de fusion peut varier légèrement en fonction de la forme spécifique de l’acide du lait.
Densité d’acide lactique g/mL
La densité de l’acide du lait est d’environ 1,2 grammes par millilitre (g/mL). Cette valeur de densité indique la masse d’acide du lait présente dans un volume donné. C’est une caractéristique importante utilisée pour déterminer la concentration des solutions acides du lait.
Poids moléculaire de l’acide lactique
Le poids moléculaire de l’acide du lait est d’environ 90,08 grammes par mole. Il représente la somme des poids atomiques de tous les atomes d’une molécule d’acide laitier. Le poids moléculaire est utilisé dans divers calculs et analyses chimiques.
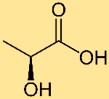
Structure de l’acide lactique
L’acide lactique a une structure constituée de trois atomes de carbone liés les uns aux autres dans une chaîne, avec un groupe hydroxyle (-OH) attaché à un carbone et un groupe carboxyle (-COOH) attaché à un autre carbone. Cette structure est responsable des propriétés acides de l’acide du lait.
Solubilité de l’acide lactique
L’acide lactique est soluble dans l’eau et forme une solution claire et incolore. Il se dissout facilement grâce à sa capacité à former des liaisons hydrogène avec les molécules d’eau. La solubilité de l’acide du lait peut varier en fonction de facteurs tels que la température et la concentration.
| Apparence | Liquide incolore |
| Gravité spécifique | 1,2 g/ml |
| Couleur | Incolore |
| Odeur | Odeur légèrement acide |
| Masse molaire | 90,08 g/mole |
| Densité | 1,2 g/ml |
| Point de fusion | 17-18 °C |
| Point d’ébullition | 122-135 °C |
| Point d’éclair | 79 °C |
| Solubilité dans l’eau | Entièrement miscible |
| Solubilité | Soluble dans l’éthanol, l’eau et l’éther |
| Pression de vapeur | 3,03 mmHg à 25 °C |
| Densité de vapeur | 2,55 (air=1) |
| pKa | 3,86 |
| pH | Environ 2,4-3,4 |
Sécurité et dangers de l’acide lactique
L’acide du lait pose certains problèmes de sécurité et certains dangers. Il est considéré comme un léger irritant pour la peau, les yeux et le système respiratoire. Le contact direct peut provoquer des irritations, des rougeurs et des inconforts. L’ingestion d’acide concentré de lait peut entraîner des douleurs abdominales, des nausées et des vomissements. Il est important de manipuler l’acide du lait avec prudence et d’utiliser des mesures de protection appropriées, telles que des gants et des lunettes. En cas de contact avec la peau ou les yeux, un rinçage abondant à l’eau est recommandé. De plus, une ventilation adéquate doit être assurée lorsque vous travaillez avec de l’acide du lait pour éviter l’inhalation de vapeurs.
| Symboles de danger | Corrosif (C), Irritant (Xi) |
| Description de la sécurité | Porter des gants de protection et une protection pour les yeux/le visage. Évitez de respirer les vapeurs. Éviter le rejet dans l’environnement. |
| Numéros d’identification de l’ONU | UN3265 |
| Code SH | 2918.12.00 |
| Classe de danger | Classe 8 (corrosif) |
| Groupe d’emballage | GE III |
| Toxicité | L’acide lactique est considéré comme ayant une faible toxicité aiguë. Cela peut provoquer des irritations et des brûlures à la peau et aux yeux. L’inhalation de vapeurs peut provoquer une irritation respiratoire. L’ingestion d’acide concentré de lait peut provoquer une irritation gastro-intestinale. Des précautions de manipulation et de sécurité appropriées doivent être suivies pour minimiser les risques potentiels. |
Méthodes de synthèse de l’acide lactique
Il existe plusieurs méthodes pour synthétiser l’acide du lait.
Une méthode courante est la fermentation des glucides par les bactéries acides du lait. Au cours de ce processus, les micro-organismes convertissent les sucres, tels que le glucose ou le lactose, en acide du lait par métabolisme anaérobie. Cette fermentation se produit naturellement dans des aliments comme le yaourt, la choucroute et les cornichons.
Une autre méthode implique une synthèse chimique utilisant l’acétaldéhyde comme matière première. L’acétaldéhyde subit une réaction avec les ions cyanure, entraînant la formation de lactonitrile. Ensuite, une hydrolyse se produit, conduisant à la conversion du lactonitrile en acide du lait. Cette méthode nécessite une manipulation soigneuse et un contrôle des conditions de réaction.
Les scientifiques produisent activement de l’acide laitier grâce à des techniques de bio-ingénierie en modifiant génétiquement des bactéries comme Escherichia coli. Ils modifient ces bactéries pour qu’elles expriment des enzymes qui convertissent le glucose ou d’autres sucres en acide du lait. Cette méthode permet la production d’acide laitier à plus grande échelle et avec un meilleur contrôle du processus.
L’acide lactique est dérivé de ressources renouvelables telles que le maïs ou la canne à sucre en hydrolysant chimiquement l’amidon ou la cellulose présente dans ces matières végétales en glucose. L’action microbienne ou enzymatique fermente ensuite le glucose en acide du lait.
Chacune de ces méthodes présente ses avantages et ses limites en termes de coût, d’évolutivité et d’impact environnemental. Le choix de la méthode de synthèse dépend de l’application spécifique et des propriétés souhaitées de l’acide laitier.
Utilisations de l’acide lactique
L’acide du lait trouve de nombreuses applications dans diverses industries. Voici quelques utilisations courantes :
- Industrie alimentaire et des boissons : l’acide du lait agit comme un conservateur naturel, un régulateur d’acidité et un exhausteur de goût dans les produits alimentaires comme les produits laitiers, les produits de boulangerie et les boissons. Il contribue au goût acidulé du yaourt et confère une saveur aigre au pain au levain.
- Industrie pharmaceutique : l’acide du lait contribue activement à la production de produits pharmaceutiques, notamment de médicaments, de pommades et de crèmes. Il sert d’ajusteur de pH et de stabilisant dans les formulations, améliorant ainsi leur efficacité et leur durée de conservation.
- Soins de la peau et cosmétiques : L’acide du lait est un ingrédient clé des produits de soin de la peau en raison de ses propriétés exfoliantes. Il aide à éliminer les cellules mortes de la peau, favorisant un teint plus lisse et plus lumineux. Les crèmes et lotions anti-âge l’utilisent activement comme ingrédient.
- Industrie textile : Dans l’industrie textile, l’acide du lait participe activement à la teinture et régule le pH pendant les processus de teinture et d’impression. Il aide à améliorer la solidité des couleurs et la pénétration des colorants.
- Bioplastiques : L’acide du lait est un précurseur pour la production de polymères biodégradables tels que l’acide du lait poly (PLA). Les entreprises utilisent largement le PLA dans les matériaux d’emballage, les couverts jetables et d’autres produits respectueux de l’environnement.
- Produits de nettoyage : Les produits de nettoyage utilisent l’acide du lait comme puissant désinfectant et détartrant naturel. Il aide à éliminer les dépôts minéraux et les taches des surfaces, ce qui en fait une alternative écologique aux produits chimiques agressifs.
- Applications industrielles : L’acide du lait sert de matière première pour la synthèse de divers produits chimiques, notamment les lactates, les solvants et les plastiques biodégradables.
La nature polyvalente de l’acide laitier en fait un ingrédient précieux dans diverses industries, contribuant au développement de produits durables et fonctionnels.
Des questions:
Q : Qu’est-ce que l’acide lactique ?
R : L’acide du lait est un composé produit par les muscles lors d’un exercice intense ou de la fermentation des sucres par des micro-organismes, présents dans les aliments fermentés comme le yaourt.
Q : Où se produit la fermentation lactique ?
R : La fermentation acide du lait se produit dans divers organismes, notamment les bactéries, les champignons et nos propres cellules musculaires.
Q : Qu’est-ce que la fermentation lactique ?
R : La fermentation acide du lait est un processus métabolique qui convertit les sucres en acide lactique, se produisant en l’absence d’oxygène, entraînant une production d’énergie.
Q : À quoi sert l’acide lactique ?
R : L’acide du lait contribue à la fatigue et aux douleurs musculaires, régule les niveaux d’acidité dans le corps et sert d’intermédiaire dans diverses voies biochimiques.
Q : Quelle est une utilisation commerciale de la fermentation lactique ?
R : La fermentation acide du lait est utilisée commercialement dans la production de yaourt, de choucroute, de cornichons et d’autres aliments fermentés.
Q : Comment se débarrasser de l’acide lactique ?
R : Des exercices doux, une hydratation adéquate et des étirements peuvent aider à éliminer et à décomposer l’acide lactique des muscles.
Q : Où trouve-t-on l’acide lactique ?
R : L’acide du lait se trouve dans diverses sources naturelles, telles que les produits laitiers, les aliments fermentés et les muscles des animaux.
Q : Comment réduire l’acide lactique dans le corps ?
R : Pour réduire l’accumulation d’acide dans le lait, on peut intégrer des routines d’échauffement et de récupération appropriées, maintenir une alimentation équilibrée et augmenter progressivement l’intensité de l’exercice au fil du temps.
