L’acide iodhydrique (HI) est un acide fort formé d’hydrogène et d’iode. Il est utilisé en synthèse organique et comme agent réducteur. Il est très corrosif et nécessite une manipulation soigneuse.
| Nom UICPA | Acide iodhydrique |
| Formule moléculaire | SALUT |
| Numero CAS | 10034-85-2 |
| Synonymes | Acide iodhydrique, iodure d’hydrogène, iodane |
| InChI | InChI=1S/HI/h1H |
Propriétés de l’acide iodhydrique
Formule d’acide iodhydrique
La formule chimique de l’iodure d’hydrogène est HI. Il se compose d’un atome d’hydrogène (H) lié à un atome d’iode (I). Cette formule simple représente la composition de cet acide fort.
Acide Iodhydrique Masse molaire
La masse molaire de l’iodure d’hydrogène (HI) est d’environ 127,91 grammes par mole (g/mol). Cette valeur est calculée en additionnant les masses atomiques d’un atome d’hydrogène et d’un atome d’iode.
Point d’ébullition de l’acide iodhydrique
L’iodure d’hydrogène a un point d’ébullition relativement bas, d’environ -35 degrés Celsius (-31 degrés Fahrenheit). À cette température, la forme liquide du HI passe à l’état gazeux.
Acide iodhydrique Point de fusion
Le point de fusion de l’iodure d’hydrogène est d’environ -51 degrés Celsius (-60 degrés Fahrenheit). À cette température, la forme solide de HI se transforme en état liquide.
Densité de l’acide iodhydrique g/mL
La densité de l’iodure d’hydrogène est d’environ 2,85 grammes par millilitre (g/mL). Cette mesure de densité indique la masse de HI présente dans un millilitre de la substance.
Acide iodhydrique Poids moléculaire
L’iodure d’hydrogène a un poids moléculaire d’environ 127,91 g/mol. Cette valeur est la somme des poids atomiques de l’hydrogène et de l’iode dans la molécule HI.
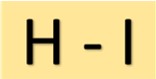
Structure de l’acide iodhydrique
L’acide iodhydrique (HI) présente une structure simple. Il se compose d’un atome d’hydrogène lié à un atome d’iode par une simple liaison covalente. Cet arrangement moléculaire confère à HI ses propriétés caractéristiques.
Solubilité de l’acide iodhydrique
L’acide iodhydrique présente une solubilité élevée dans l’eau. Lorsqu’il est mélangé à de l’eau, il se dissout facilement pour former une solution incolore. Sa haute solubilité contribue à son utilisation généralisée dans diverses applications, notamment la synthèse chimique.
| Apparence | Liquide incolore |
| Gravité spécifique | 2,85 g/ml |
| Couleur | Incolore |
| Odeur | Âcre |
| Masse molaire | 127,91 g/mole |
| Densité | 2,85 g/ml |
| Point de fusion | -51°C (-60°F) |
| Point d’ébullition | -35°C (-31°F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Miscible, formant une solution incolore |
| Solubilité | Soluble dans les solvants organiques |
| Pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | -dix |
| pH | Très acide (pH < 1) |
Sécurité et dangers de l’acide iodhydrique
L’iodure d’hydrogène (HI) présente des risques importants pour la sécurité en raison de sa nature corrosive. Il peut provoquer de graves brûlures de la peau et des lésions oculaires au contact. L’inhalation de ses vapeurs entraîne une irritation respiratoire. Un équipement de protection approprié, comme des gants et des lunettes, doit être utilisé lors de la manipulation de HI. Il doit être stocké dans un endroit bien ventilé, à l’écart des substances incompatibles. En cas d’ingestion ou d’inhalation accidentelle, consultez immédiatement un médecin. En cas de déversement, neutraliser avec des agents appropriés et éliminer comme déchet dangereux. Il est essentiel de suivre des protocoles de sécurité stricts et de manipuler avec prudence pour éviter les accidents et les blessures.
| Symboles de danger | Corrosif |
| Description de la sécurité | Provoque de graves brûlures de la peau et des lésions oculaires. Nocif en cas d’inhalation. |
| Numéros d’identification de l’ONU | UN1787 |
| Code SH | 28111990 |
| Classe de danger | 8 (Substances corrosives) |
| Groupe d’emballage | II |
| Toxicité | Très toxique |
Méthodes de synthèse de l’acide iodhydrique
L’iodure d’hydrogène (HI) peut être synthétisé par diverses méthodes. Une approche courante implique la réaction directe de l’iode (I2) avec le phosphore rouge (P). Dans cette méthode, I2 est mélangé avec du phosphore rouge, qui agit comme agent réducteur. La réaction a lieu en présence d’eau, donnant du HI et de l’acide phosphorique.
Une autre méthode implique la réaction de l’iode avec l’hydrate d’hydrazine (N2H4·H2O). Ce processus nécessite une manipulation prudente en raison de la nature potentiellement dangereuse de l’hydrate d’hydrazine. La réaction entraîne la formation de HI et d’azote gazeux.
Alternativement, la réaction de l’iode avec l’acide sulfurique concentré (H2SO4) peut également produire du HI. Dans cette méthode, l’iode est mélangé à de l’acide sulfurique concentré, conduisant à la génération de gaz HI, qui peut être collecté et condensé sous forme liquide.
Il est essentiel de noter que la synthèse de l’iodure d’hydrogène doit être effectuée avec les précautions de sécurité appropriées. Les produits chimiques impliqués peuvent être dangereux et les réactions peuvent générer des gaz toxiques. Une ventilation adéquate, des équipements de protection et le respect des consignes de sécurité sont cruciaux pendant le processus de synthèse pour garantir une production sûre et réussie d’iodure d’hydrogène.
Utilisations de l’acide iodhydrique
L’iodure d’hydrogène (HI) trouve diverses applications dans diverses industries en raison de ses propriétés uniques. Voici quelques utilisations clés :
- Synthèse organique : La chimie organique utilise l’HI comme réactif essentiel pour convertir les halogénures d’alkyle en alcanes, un processus connu sous le nom de déshalogénation.
- Industrie pharmaceutique : La production de divers composés pharmaceutiques, notamment de médicaments contenant de l’iode et d’agents de contraste iodés pour l’imagerie médicale, repose sur HI.
- Agent réducteur : HI fonctionne activement comme un puissant agent réducteur dans les réactions chimiques, aidant à la réduction des ions métalliques en leurs formes élémentaires.
- Catalyse : HI participe activement en tant que catalyseur à certaines réactions chimiques, augmentant les taux de réaction et améliorant le rendement de transformations spécifiques.
- Nettoyage et gravure : Les industries de l’électronique et des semi-conducteurs utilisent activement l’HI pour les processus de nettoyage et de gravure en raison de sa capacité à dissoudre les métaux et les oxydes métalliques.
- Chimie analytique : les titrages iodométriques en chimie analytique utilisent activement l’HI pour déterminer la concentration de certaines substances en fonction de leur réaction avec l’iode.
- Traitement des surfaces métalliques : HI joue activement un rôle dans la préparation des surfaces métalliques pour le placage, le brasage et d’autres processus de traitement de surface.
- Fabrication d’iodures : diverses industries utilisent activement l’HI pour produire des composés d’iodure pour diverses applications dans des domaines tels que la photographie, la médecine et la synthèse organique.
- Réactif de laboratoire : Les laboratoires utilisent activement l’HI comme réactif utile pour de nombreuses réactions et expériences chimiques.
Les propriétés polyvalentes de l’iodure d’hydrogène en font un outil précieux dans la recherche chimique, les processus industriels et le développement pharmaceutique, contribuant aux progrès dans de multiples secteurs et aux découvertes scientifiques.
Des questions:
Q : Quel composé pourrait être ajouté à l’acide iodhydrique (HI) pour neutraliser ses propriétés acides ?
R : Une base, telle que l’hydroxyde de sodium (NaOH), peut être ajoutée pour neutraliser l’iodure d’hydrogène et former de l’eau et un sel.
Q : L’acide iodhydrique est-il un acide fort ?
R : Oui, l’iodure d’hydrogène est un acide fort, ce qui signifie qu’il s’ionise complètement dans l’eau, libérant des ions hydrogène.
Q : Quelle est la formule de l’acide iodhydrique ?
R : La formule de l’iodure d’hydrogène est HI, représentant un atome d’hydrogène lié à un atome d’iode.
Q : Laquelle des formules suivantes est la formule de l’acide iodhydrique ?
R : La formule de l’iodure d’hydrogène est HI.
Q : Combien de millilitres d’acide iodhydrique 0,550 M sont nécessaires pour réagir avec 10,00 ml de CsOH 0,217 M ?
R : Environ 17,58 ml d’iodure d’hydrogène 0,550 M sont nécessaires pour réagir avec 10,00 ml de CsOH 0,217 M.
Q : L’acide iodhydrique est-il illégal ?
R : L’iodure d’hydrogène en lui-même n’est pas illégal, mais son utilisation et sa possession peuvent être réglementées en raison de ses dangers potentiels et de ses applications dans des activités illégales.
Q : Que forment l’iodure d’hydrogène et le sulfure de magnésium ?
R : L’iodure d’hydrogène et le sulfure de magnésium réagissent pour former du sulfure d’hydrogène (H2S) gazeux et du sel d’iodure de magnésium (MgI2).
Q : Que se passe-t-il lorsque vous mélangez de l’iodure d’hydrogène avec du bicarbonate de soude ?
R : Lorsque l’iodure d’hydrogène réagit avec le bicarbonate de soude (bicarbonate de sodium), il produit du dioxyde de carbone, de l’eau et de l’iodure de sodium.
Q : Comment l’iodure d’hydrogène agit-il dans l’eau ?
R : L’iodure d’hydrogène s’ionise dans l’eau, libérant des ions hydrogène (H+) et des ions iodure (I-), ce qui donne une solution très acide.
Q : Équation ionique nette de l’hydroxyde de sodium et de l’iodure d’hydrogène ?
R : L’équation ionique nette de la réaction entre l’hydroxyde de sodium (NaOH) et l’iodure d’hydrogène (HI) est Na+ + OH- + H+ + I- → Na+ + I- + H2O.
