L’acide fluoroantimonique est l’un des superacides les plus puissants connus, avec une fonction d’acidité de Hammett de -21. C’est un mélange de fluorure d’hydrogène et de pentafluorure d’antimoine.
| Nom UICPA | Acide fluoroantimoine (V) |
| Formule moléculaire | H[SbF6] |
| Numero CAS | 16950-06-4 |
| Synonymes | Hexafluoroantimonate d’hydrogène (V), Hexafluorure d’antimoine hydraté, Fluorure d’hydrogène et d’antimoine, Acide fluorhydrique avec pentafluoroantimoine (1:1) |
| InChI | InChI=1S/F6Sb.H/h1H;/q+1;/p-1 |
pH de l’acide fluoroantimonique
L’acide fluoroantimonique est un superacide et a un pH inférieur à -14. En effet, l’échelle de pH mesure la concentration d’ions hydrogène (H+) dans une solution et les superacides ont des concentrations d’ions H+ plus élevées que l’eau pure.
Les pH-mètres traditionnels ne peuvent pas mesurer avec précision le pH de l’acide fluoroantimonique, car ils ne sont pas conçus pour gérer des acides aussi forts. Au lieu de cela, les scientifiques utilisent la fonction d’acidité de Hammett pour mesurer l’acidité de l’acide fluoroantimonique. La fonction d’acidité de Hammett compare l’acidité des superacides en utilisant le degré de protonation d’un composé de référence. L’acide fluoroantimonique a une fonction d’acidité de Hammett de -21, ce qui est la valeur la plus négative possible et indique qu’il s’agit de l’un des superacides connus les plus puissants.
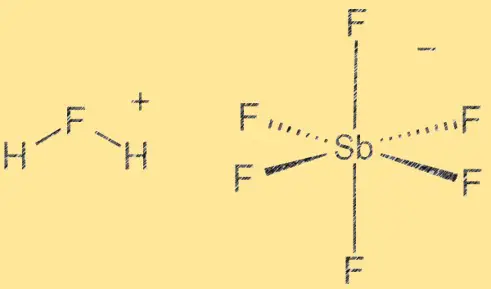
Structure de l’acide fluoroantimonique :
L’acide fluoroantimonique a une structure moléculaire composée d’un ion hydrogène (H+) et d’un ion hexafluoroantimonate (V) ([SbF6]^-). L’ion SbF6 agit comme un acide de Lewis, tandis que l’ion H+ agit comme un acide de Bronsted. Le composé est hautement polaire en raison de la différence d’électronégativité entre les atomes d’hydrogène et de fluor. La liaison entre l’antimoine et le fluorure est covalente, tandis que la liaison entre l’hydrogène et le fluorure est covalente polaire.
Masse molaire de Acide Fluoroantimonique:
L’acide fluoroantimonique a une masse molaire de 216,74 g/mol. C’est un superacide hautement réactif et corrosif composé de fluorure d’hydrogène (HF) et de pentafluorure d’antimoine (SbF5). La masse molaire élevée de l’acide fluoroantimonique peut être attribuée à la présence de l’atome lourd d’antimoine dans sa structure moléculaire.
Point d’ébullition de l’acide fluoroantimonique :
HSbF6 est un composé hautement réactif et instable et n’a donc pas de point d’ébullition défini. Il se décompose à des températures supérieures à -10°C, libérant des fumées toxiques de fluorure d’hydrogène gazeux. Son point d’ébullition est estimé aux alentours de 20-30°C, mais ce n’est pas un paramètre utile pour décrire les propriétés du HSbF6.
Point de fusion de l’acide fluoroantimonique :
HSbF6 n’a pas de point de fusion bien défini en raison de sa nature hautement réactive. Il ne peut exister qu’à l’état liquide et se décompose rapidement lors du refroidissement à des températures plus basses. On estime qu’il se décompose vers -90°C, libérant des fumées toxiques de fluorure d’hydrogène et de pentafluorure d’antimoine.
Densité de l’acide fluoroantimonique g/ml :
La densité de HSbF6 est de 2,1 g/mL. Cette densité élevée peut être attribuée à la présence d’atomes lourds d’antimoine dans sa structure moléculaire. C’est un composé hautement corrosif et réactif et doit être manipulé avec une extrême prudence. La densité du HSbF6 le rend également difficile à manipuler en laboratoire.
Poids moléculaire de l’acide fluoroantimonique :
Le poids moléculaire de l’acide fluoroantimonique est de 236,76 g/mol. Il est composé d’un ion hydrogène, d’un ion antimoine et de six ions fluorure. Le poids moléculaire élevé de l’acide fluoroantimonique peut être attribué à la présence de l’atome lourd d’antimoine dans sa structure moléculaire.
Formule d’acide fluoroantimonique :
La formule chimique de l’acide fluoroantimonique est H[SbF6]. Il est composé d’un ion hydrogène (H+) et d’un ion hexafluoroantimonate (V) ([SbF6]^-). L’ion [SbF6]^- est formé par la réaction du pentafluorure d’antimoine (SbF5) avec le fluorure d’hydrogène (HF). La formule représente le rapport en nombres entiers le plus simple des atomes présents dans le composé.
| Apparence | Liquide incolore à jaune pâle |
| Gravité spécifique | 2,1 g/ml |
| Couleur | Incolore à jaune pâle |
| Odeur | Inodore |
| Masse molaire | 236,76 g/mole |
| Densité | 2,1 g/ml |
| Point de fusion | Se décompose vers -90°C |
| Point d’ébullition | Se décompose au-dessus de -10°C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Réagit violemment avec l’eau |
| Solubilité | Soluble dans HF anhydre, SbF5, SO2F2 et SO2ClF |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| PKa | -21 (fonction d’acidité de Hammett) |
| pH | Moins de -14 |
Remarque : L’acide fluoroantimonique est un composé hautement réactif et corrosif qui doit être manipulé avec une extrême prudence. Ses propriétés physiques et chimiques sont difficiles à mesurer avec précision en raison de sa nature instable et des méthodes limitées disponibles pour sa manipulation. Les valeurs répertoriées dans ce tableau sont des estimations basées sur la littérature disponible et peuvent ne pas être précises.
Sécurité et dangers de l’acide fluoroantimonique
L’acide fluoroantimonique est une substance extrêmement dangereuse et hautement corrosive qui présente des risques importants pour la santé et la sécurité. C’est un agent oxydant puissant qui peut réagir violemment avec l’eau, les composés organiques et même certains métaux. Il peut provoquer de graves brûlures et des lésions tissulaires au contact de la peau ou des yeux, et l’inhalation de ses vapeurs peut entraîner une détresse respiratoire et des lésions pulmonaires.
Le personnel formé doit manipuler l’acide fluoroantimonique à l’aide d’un équipement spécialisé et de vêtements de protection dans des laboratoires bien ventilés et correctement équipés. Les agences de réglementation réglementent et limitent strictement l’utilisation de l’acide fluoroantimonique en raison de son potentiel à causer des blessures graves et des dommages environnementaux.
| Symboles de danger | Corrosif |
| Description de la sécurité | Ne respirez pas les vapeurs. Portez des gants, des vêtements et une protection des yeux/du visage. Évitez tout contact avec la peau, les yeux et les vêtements. Utiliser uniquement sous une hotte chimique. |
| Numéros d’identification de l’ONU | UN3264 |
| Code SH | 28111990 |
| Classe de danger | 8 (Substances corrosives) |
| Groupe d’emballage | III |
| Toxicité | Très toxique et corrosif ; peut provoquer de graves brûlures et des lésions tissulaires au contact de la peau ou des yeux, et l’inhalation de ses vapeurs peut entraîner une détresse respiratoire et des lésions pulmonaires. |
Méthodes de synthèse de l’acide fluoroantimonique
L’acide fluoroantimonique (HSbF6) est généralement synthétisé en mélangeant du fluorure d’hydrogène (HF) et du pentafluorure d’antimoine (SbF5) dans un rapport molaire de 1:1. La réaction a lieu dans des conditions anhydres et à basse température pour empêcher la décomposition du superacide résultant. La réaction globale peut être représentée comme suit :
HF + SbF5 → HSbF6
La réaction est hautement exothermique et peut dégager une grande quantité de chaleur. Par conséquent, elle est généralement réalisée dans un environnement bien ventilé et contrôlé, tel qu’une sorbonne chimique, en utilisant des mesures de protection appropriées.
Pour préparer HSbF6, on peut faire réagir du trifluorure d’antimoine (SbF3) avec du HF en présence d’un agent oxydant comme le SbF5 ou le difluorure de dioxyde de soufre (SO2F2). Cette réaction nécessite des conditions anhydres et de basses températures. La réaction peut s’exprimer ainsi :
SbF3 + 3HF + SO2F2 → HSbF6 + SO2
HSbF6 est un composé hautement réactif et instable qui nécessite une manipulation et un stockage spéciaux. Il est généralement stocké dans des conteneurs scellés et hermétiques dans des conditions anhydres et à basse température pour éviter la décomposition. Des mesures de sécurité et des équipements de protection appropriés sont essentiels lorsque l’on travaille avec HSbF6 en raison de sa toxicité et de sa corrosivité élevées.
Utilisations de l’acide fluoroantimonique
L’acide fluoroantimonique (HSbF6) est l’un des superacides connus les plus puissants et possède un large éventail d’applications industrielles et de recherche. Voici quelques-unes des utilisations de l’acide fluoroantimonique :
- HSbF6 sert de catalyseur dans diverses réactions chimiques, notamment les alkylations, les isomérisations et les polymérisations.
- L’industrie pétrochimique utilise le HSbF6 dans la production d’essence à indice d’octane élevé et d’autres hydrocarbures.
- Les chercheurs de l’industrie pharmaceutique utilisent HSbF6 comme catalyseur dans la synthèse de divers produits pharmaceutiques, notamment des médicaments antiviraux et anticancéreux.
- HSbF6 trouve une application dans la gravure et le nettoyage de composants électroniques, tels que les micropuces et les semi-conducteurs, utilisés dans la production de composants électroniques.
- Les scientifiques utilisent HSbF6 comme outil de recherche dans divers domaines de la chimie et de la science des matériaux, notamment la synthèse de nouveaux matériaux et l’étude des réactions chimiques.
HSbF6 est une substance hautement réactive et dangereuse qui nécessite une manipulation et des mesures de protection spécialisées. Il est strictement réglementé et ne doit être utilisé que par du personnel formé dans des laboratoires bien équipés. Les dangers potentiels associés au HSbF6 limitent son utilisation à des applications spécialisées pour lesquelles aucune autre alternative n’est disponible.
Des questions:
L’acide fluoroantimonique peut-il dissoudre le diamant ?
HSbF6 peut dissoudre le diamant en raison de ses fortes propriétés acides. Des professionnels formés dans des laboratoires bien équipés, dotés de mesures de sécurité et d’équipements de protection appropriés, peuvent effectuer la réaction très dangereuse entre le diamant et le HSbF6. Cependant, il ne s’agit pas d’une méthode pratique ou rentable pour le traitement ou la taille du diamant. La découpe mécanique ou la découpe laser sont beaucoup plus couramment utilisées en raison de leur efficacité et de leur sécurité.
Où acheter de l’acide fluoroantimonique ?
L’achat de HSbF6 est extrêmement difficile en raison de sa nature très dangereuse et réglementée. Seules les entreprises ou institutions agréées et autorisées possédant les permis et l’équipement nécessaires peuvent manipuler et stocker l’acide en toute sécurité.
La Convention sur les armes chimiques (CAC) et les réglementations américaines sur les normes antiterroristes pour les installations chimiques (CFATS) classent le HSbF6 comme une substance dangereuse et contrôlée.
Les agences gouvernementales telles que l’Environmental Protection Agency (EPA), le Department of Homeland Security (DHS) et le Bureau of Industry and Security (BIS) réglementent et contrôlent strictement la vente et l’achat de HSbF6.
Si vous avez un besoin légitime de HSbF6, vous pouvez contacter des fournisseurs de produits chimiques agréés ou des instituts de recherche disposant des permis et de l’expertise nécessaires.
Cependant, vous devez fournir une justification détaillée et obtenir les approbations et permis nécessaires avant de procéder à tout achat.
