Le cyanure d’hydrogène est un composé hautement toxique utilisé dans les industries, connu pour ses effets mortels sur le système respiratoire. Il est incolore, a une odeur distincte et présente des risques importants pour la santé humaine.
| Nom UICPA | Cyanure d’hydrogène |
| Formule moléculaire | HCN |
| Numero CAS | 74-90-8 |
| Synonymes | Acide prussique, Formonitrile, Acide hydrocyanique, Acide cyanhydrique |
| InChI | InChI=1S/CHN/c1-2/h1H |
Propriétés du cyanure d’hydrogène
Formule de cyanure d’hydrogène
La formule de l’acide cyanhydrique est HCN. Il se compose d’un atome d’hydrogène (H) lié à un atome de carbone (C) par une triple liaison, et l’atome de carbone est en outre lié à un atome d’azote (N). Cette formule moléculaire simple représente la composition de l’acide cyanhydrique.
Cyanure D’hydrogène Masse molaire
La masse molaire de l’acide cyanhydrique est d’environ 27,03 grammes par mole. Il est calculé en additionnant les masses atomiques d’hydrogène (H), de carbone (C) et d’azote (N) présentes dans une molécule d’acide cyanhydrique.
Point d’ébullition du cyanure d’hydrogène
L’acide cyanhydrique a un point d’ébullition d’environ 25,7 degrés Celsius (78,3 degrés Fahrenheit). A cette température, l’acide cyanhydrique passe de l’état liquide à l’état gazeux, dégageant des fumées toxiques.
Point de fusion du cyanure d’hydrogène
Le point de fusion de l’acide cyanhydrique est d’environ -13,4 degrés Celsius (7,9 degrés Fahrenheit). À cette température, l’acide cyanhydrique passe de l’état solide à l’état liquide.
Densité du cyanure d’hydrogène g/mL
La densité de l’acide cyanhydrique est d’environ 0,687 gramme par millilitre. Cette valeur de densité représente la masse d’acide cyanhydrique par unité de volume.
Cyanure D’hydrogène Poids moléculaire
Le poids moléculaire de l’acide cyanhydrique est d’environ 27,03 grammes par mole. Il est déterminé en additionnant les poids atomiques de ses éléments constitutifs.
Structure du cyanure d’hydrogène
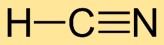
L’acide cyanhydrique a une structure moléculaire linéaire, avec l’atome d’hydrogène (H) lié à l’atome de carbone (C) et l’atome de carbone (C) lié à l’atome d’azote (N). La triple liaison entre le carbone et l’azote confère une stabilité à la molécule.
Solubilité du cyanure d’hydrogène
L’acide cyanhydrique est très soluble dans l’eau. Il se dissout facilement dans l’eau, formant une solution incolore. Cette solubilité permet à l’acide cyanhydrique de se mélanger et d’interagir facilement avec d’autres substances dans diverses applications et environnements.
| Apparence | Gaz incolore |
| Gravité spécifique | 0,687 |
| Couleur | Incolore |
| Odeur | Odeur distincte |
| Masse molaire | 27,03 g/mole |
| Densité | 0,687 g/ml |
| Point de fusion | -13,4°C (-7,9°F) |
| Point d’ébullition | 25,7°C (78,3°F) |
| Point d’éclair | -17,8°C (0°F) |
| Solubilité dans l’eau | Miscible à l’eau |
| Solubilité | Soluble dans les solvants organiques tels que l’éther et l’alcool éthylique |
| La pression de vapeur | 500 mmHg à 20°C |
| Densité de vapeur | 0,95 |
| pKa | 9.3 |
| pH | 5,6 (acide cyanhydrique dilué) |
Sécurité et dangers du cyanure d’hydrogène
L’acide cyanhydrique présente des risques importants pour la sécurité et doit être manipulé avec une extrême prudence. Il est hautement toxique lorsqu’il est inhalé, ingéré ou absorbé par la peau. L’exposition à l’acide cyanhydrique peut entraîner une détresse respiratoire grave, un arrêt cardiaque et même la mort. Il est important d’assurer une ventilation adéquate et d’utiliser un équipement de protection individuelle lorsque vous travaillez avec ou à proximité de l’acide cyanhydrique. De plus, le composé est inflammable et peut former des mélanges explosifs avec l’air. Le stockage doit être effectué dans des conteneurs hermétiquement fermés, à l’écart des sources d’inflammation. Des protocoles d’urgence, tels que la fourniture de soins médicaux immédiats et l’évacuation des zones touchées, doivent être en place pour atténuer les risques associés à l’exposition à l’acide cyanhydrique.
| Symboles de danger | Crâne et os croisés |
| Description de la sécurité | Très toxique ; manipuler avec une extrême prudence |
| Numéros d’identification de l’ONU | UN1051 (Acide hydrocyanique) |
| Code SH | 2811.11.00 |
| Classe de danger | 6.1 (Substances toxiques) |
| Groupe d’emballage | Je (Grand danger) |
| Toxicité | Extrêmement toxique ; peut être mortel même en petites quantités |
Méthodes de synthèse du cyanure d’hydrogène
Diverses méthodes peuvent synthétiser l’acide cyanhydrique.
Une méthode courante est le processus Andrussow. Dans ce procédé, les catalyseurs platine ou rhodium facilitent la réaction de l’ammoniac (NH₃) et du méthane (CH₄) avec l’oxygène (O₂) pour synthétiser l’acide cyanhydrique. La réaction a lieu à des températures élevées, généralement autour de 1 000 à 1 200°C. Le méthane agit comme un agent réducteur, convertissant l’oxygène en eau (H₂O), tandis que l’ammoniac fournit la source d’azote. Le mélange résultant subit une série de réactions conduisant à la formation d’acide cyanhydrique (HCN) et de vapeur d’eau.
Une autre méthode de synthèse de l’acide cyanhydrique est le procédé BMA. Il s’agit de la réaction du méthane (CH₄) avec l’ammoniac (NH₃) en présence d’un catalyseur, tel que le cuivre ou le nickel, à haute température. Ce processus génère de l’acide cyanhydrique ainsi que d’autres sous-produits.
Le procédé Andrussov-Noddack produit de l’acide cyanhydrique en faisant réagir du cyanure de sodium (NaCN) avec un acide fort, tel que l’acide sulfurique (H₂SO₄).
Il convient de mentionner que l’acide cyanhydrique est un composé hautement toxique et que sa synthèse doit être effectuée avec le plus grand soin dans des installations bien équipées, en suivant des protocoles de sécurité appropriés. L’utilisation d’équipements spécialisés, une ventilation adéquate et le respect des consignes de sécurité sont essentiels pour garantir le bien-être du personnel impliqué dans le processus de synthèse.
Utilisations du cyanure d’hydrogène
L’acide cyanhydrique trouve des applications dans diverses industries en raison de ses propriétés uniques. Voici quelques-unes de ses utilisations :
- Fabrication de produits chimiques : l’acide cyanhydrique joue un rôle crucial dans la synthèse de plusieurs produits chimiques importants, notamment l’adiponitrile (un composant clé dans la production de nylon), le méthacrylate de méthyle (utilisé pour les plastiques acryliques) et le cyanure de sodium (utilisé dans l’extraction de l’or).
- Produits pharmaceutiques : La production de produits pharmaceutiques, tels que les vitamines, les acides aminés synthétiques et certains antibiotiques, repose sur l’acide cyanhydrique.
- Fumigation : les industries utilisent l’acide cyanhydrique comme fumigant pour lutter contre les parasites, en particulier dans les espaces clos comme les serres, les cales de navire et les installations de stockage de céréales.
- Placage de métaux : les industries métallurgiques utilisent de l’acide cyanhydrique pour les processus de galvanoplastie afin de fournir une couche protectrice sur les surfaces métalliques.
- Fabrication de polymères : L’acide cyanhydrique participe activement à la production de fibres synthétiques, de caoutchouc et de résines.
- Insecticides : Certains insecticides contiennent des ingrédients actifs dérivés de l’acide cyanhydrique pour assurer une lutte efficace contre les ravageurs en agriculture et en foresterie.
- Réactif de laboratoire : L’acide cyanhydrique sert de réactif dans diverses réactions chimiques et procédures de laboratoire.
- Exploitation minière : Dans l’extraction de l’or et de l’argent, l’acide cyanhydrique agit comme un réactif chimique pour extraire les métaux précieux des minerais.
- Production de caoutchouc synthétique : L’acide cyanhydrique sert de matière première dans la production de caoutchouc synthétique, tel que le caoutchouc styrène-butadiène (SBR).
- Colorants et pigments : La fabrication de colorants et de pigments implique l’utilisation d’acide cyanhydrique, contribuant à leurs propriétés de coloration.
Bien que l’acide cyanhydrique ait ses utilités, il est important de le manipuler avec le plus grand soin en raison de sa haute toxicité. Des protocoles de sécurité stricts et le respect de procédures de manipulation appropriées sont essentiels pour minimiser les risques associés à son utilisation.
Des questions:
Q : À quoi sert le cyanure d’hydrogène ?
R : L’acide cyanhydrique est utilisé dans la fabrication de produits chimiques, la production pharmaceutique, la fumigation, le placage métallique, les insecticides et comme réactif de laboratoire, entre autres applications.
Q : Quelle est la formule chimique du cyanure d’hydrogène ?
R : La formule chimique de l’acide cyanhydrique est HCN.
Q : Quelles sont les « utilisations autorisées » du cyanure d’hydrogène ?
R : Les « objectifs autorisés » du HCN incluent son utilisation approuvée et réglementée dans des processus industriels spécifiques, la recherche et d’autres applications autorisées.
Q : Dans quoi trouve-t-on du cyanure d’hydrogène ?
R : L’acide cyanhydrique peut être trouvé dans divers produits chimiques, milieux industriels et sources naturelles telles que certaines plantes et graines.
Q : Où pouvez-vous acheter du cyanure d’hydrogène ?
R : L’achat de cyanure d’hydrogène est hautement restreint et réglementé en raison de sa toxicité et de son utilisation abusive potentielle.
Q : Qu’est-ce que le cyanure d’hydrogène ?
R : L’acide cyanhydrique est un composé hautement toxique et volatil avec une odeur distincte, couramment utilisé dans les processus industriels.
Q : Le cyanure d’hydrogène est-il polaire ou non polaire ?
R : L’acide cyanhydrique est une molécule polaire en raison de la présence de liaisons polaires et d’une distribution asymétrique de la densité électronique.
Q : Quel mot ou quelle expression de deux mots décrit le mieux la forme de la molécule de cyanure d’hydrogène (HCN) ?
R : La forme de la molécule HCN est linéaire.
Q : À quoi sert le cyanure d’hydrogène ?
R : L’acide cyanhydrique est utilisé dans diverses industries pour la synthèse chimique, la fumigation, le placage métallique, les insecticides et la production pharmaceutique.
Q : Le cyanure d’hydrogène a-t-il été utilisé lors d’une attaque terroriste ?
R : Oui, le HCN a été utilisé dans le passé comme arme chimique lors d’attaques terroristes.
Q : Quels sont les autres noms chimiques associés au cyanure d’hydrogène ?
R : Les autres noms chimiques associés au HCN incluent l’acide prussique, le formonitrile, l’acide cyanhydrique et l’acide cyanhydrique.
Q : Quel est le diagramme de points de Lewis correct pour le cyanure d’hydrogène ?
R : Le diagramme de points de Lewis correct pour HCN comprend l’atome d’hydrogène (H) lié à l’atome de carbone (C) par une simple liaison, et l’atome de carbone (C) lié à l’atome d’azote (N) par une triple liaison.
Q : Quelle est la charge des atomes du cyanure d’hydrogène ?
R : Dans HCN, l’atome d’hydrogène (H) a une charge partielle positive, l’atome de carbone (C) a une charge partielle négative et l’atome d’azote (N) a une charge partielle négative.
Q : Qu’est-ce qu’une capsule de cyanure d’hydrogène vous fait ?
R : Dans des contextes hautement réglementés et contrôlés, une capsule de HCN peut être utilisée comme moyen d’auto-administration rapide et mortelle, généralement à des fins secrètes ou d’urgence.
Q : Quel type de liaison est la liaison carbone-azote dans une molécule de cyanure d’hydrogène (HCN) ?
R : La liaison carbone-azote dans une molécule de HCN est une triple liaison.
