L’acide citrique est un acide naturel présent dans les agrumes. Il est largement utilisé dans les aliments et les boissons comme exhausteur de goût et conservateur. Il trouve également des applications dans les produits d’entretien et les cosmétiques.
| Nom UICPA | Acide 2-hydroxypropane-1,2,3-tricarboxylique |
| Formule moléculaire | C₆H₈O₇ |
| Numero CAS | 77-92-9 |
| Synonymes | Acide 3-carboxy-3-hydroxyglutarique, acide 2-hydroxy-1,2,3-propanetricarboxylique, citrate, etc. |
| InChI | InChI=1S/C6H8O7/c7-3(8)1-6(13,5(11)12)2-4(9)10/h13H,1-2H2,(H,7,8)(H,9, 10)(H,11,12) |
Propriétés de l’acide citrique
Formule d’acide citrique
La formule de l’acide citrique est C₆H₈O₇. Il se compose de six atomes de carbone, huit atomes d’hydrogène et sept atomes d’oxygène. Cette formule chimique représente la disposition des atomes dans une seule molécule d’acide citrique.
Acide Citrique Masse molaire
La masse molaire de C₆H₈O₇ est d’environ 192,13 grammes par mole. Il est calculé en additionnant les masses atomiques de tous les atomes présents dans une mole de C₆H₈O₇. La masse molaire est utilisée pour convertir entre grammes et moles dans les calculs chimiques.
Point d’ébullition de l’acide citrique
L’acide citrique n’a pas de point d’ébullition distinct car il subit une décomposition avant d’atteindre une température d’ébullition. Cependant, lorsqu’il est chauffé, il commence à se dégrader à environ 175 degrés Celsius (347 degrés Fahrenheit). La décomposition de C₆H₈O₇ entraîne la formation d’eau et de dioxyde de carbone.
Acide citrique Point de fusion
L’acide citrique a un point de fusion de 153 degrés Celsius (307 degrés Fahrenheit). À cette température, la forme solide de C₆H₈O₇ se transforme en liquide. Il est important de noter que C₆H₈O₇ peut également exister sous une forme anhydre, dont le point de fusion est plus élevé, autour de 310 degrés Celsius (590 degrés Fahrenheit).
Densité d’acide citrique g/mL
La densité de C₆H₈O₇ est d’environ 1,665 grammes par millilitre (g/mL). Cette valeur représente la masse de C₆H₈O₇ contenue dans un millilitre de volume. La densité d’une substance est souvent utilisée pour déterminer sa concentration ou sa pureté.
Acide Citrique Poids moléculaire
Le poids moléculaire de C₆H₈O₇ est d’environ 192,13 grammes par mole. C’est la somme des poids atomiques de tous les atomes d’une molécule de C₆H₈O₇. Le poids moléculaire est un paramètre important pour divers calculs et réactions chimiques.
Structure de l’acide citrique
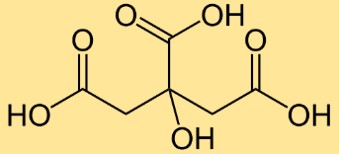
L’acide citrique a une structure d’acide tricarboxylique avec trois groupes fonctionnels carboxyle (-COOH). Il contient un atome de carbone central lié à trois groupes carboxyle et un groupe hydroxyle (-OH). La disposition des atomes confère à C₆H₈O₇ ses propriétés acides caractéristiques et lui permet de participer à divers processus biochimiques.
Solubilité de l’acide citrique
L’acide citrique est très soluble dans l’eau. Il se dissout facilement dans l’eau, l’alcool et d’autres solvants polaires. La solubilité de C₆H₈O₇ augmente avec la température. Il est couramment utilisé comme additif alimentaire et agent aromatisant en raison de sa capacité à dissoudre et à rehausser les arômes dans les solutions aqueuses.
| Apparence | Poudre cristalline blanche |
| Gravité spécifique | 1,665 |
| Couleur | Incolore ou blanc |
| Odeur | Inodore |
| Masse molaire | 192,13 g/mole |
| Densité | 1,665 g/mL |
| Point de fusion | 153 °C (307 °F) |
| Point d’ébullition | Se décompose avant de bouillir |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble |
| Solubilité | Soluble dans l’eau, l’alcool et les solvants polaires |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | pKa₁ = 3,13, pKa₂ = 4,76, pKa₃ = 6,40 |
| pH | pH = 1,8 – 3,1 (solution à 1 % à 25 °C) |
Sécurité et dangers de l’acide citrique
L’acide citrique est généralement reconnu comme étant sans danger pour la consommation et présente un faible niveau de toxicité. Cependant, sa manipulation nécessite quelques précautions. Cela peut provoquer une irritation des yeux et de la peau, il est donc recommandé de porter des gants et des lunettes de protection. L’inhalation de poussière ou de brouillard de C₆H₈O₇ peut irriter le système respiratoire, il est donc conseillé de travailler dans des zones bien ventilées. Bien qu’il ne soit pas inflammable, des températures élevées peuvent provoquer la décomposition du C₆H₈O₇ et libérer des fumées irritantes. Il est important de stocker C₆H₈O₇ dans un endroit frais et sec, à l’écart des substances incompatibles. Dans l’ensemble, la mise en œuvre de bonnes mesures de sécurité garantit une manipulation sûre du C₆H₈O₇.
| Symboles de danger | Aucun |
| Description de la sécurité | Provoque une irritation des yeux et de la peau. Peut provoquer une irritation respiratoire. Manipuler avec précaution et éviter l’inhalation |
| Numéros d’identification de l’ONU | N’est pas applicable |
| Code SH | 2918.14.00 |
| Classe de danger | Non classé comme dangereux |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Faible toxicité ; généralement reconnu comme sûr |
Méthodes de synthèse de l’acide citrique
Diverses méthodes peuvent synthétiser C₆H₈O₇.
Des micro-organismes comme certaines souches du champignon Aspergillus niger ou la bactérie Escherichia coli fermentent des glucides comme le glucose ou le saccharose dans un milieu riche en nutriments pour synthétiser du C₆H₈O₇ comme sous-produit. Ils métabolisent les sucres, produisant du C₆H₈O₇ pendant la fermentation.
Les agrumes sont initialement extraits du jus pour obtenir une solution concentrée, extrayant le C₆H₈O₇ de sources naturelles. Les procédés de purification éliminent les impuretés et les particules solides du jus. Le traitement de la solution concentrée avec de l’hydroxyde de calcium forme du citrate de calcium, un sel de C₆H₈O₇. L’acidification de la solution à l’aide d’acide sulfurique ou chlorhydrique libère C₆H₈O₇ sous forme de précipité de ce sel. La collecte, le lavage et le séchage du précipité donnent du C₆H₈O₇ pur.
Les méthodes de synthèse chimique impliquent l’oxydation catalytique du glucose ou d’autres glucides à l’aide de catalyseurs spécifiques comme le platine ou le palladium. Le glucose est converti en acide gluconique grâce à ce processus, et une oxydation ultérieure le convertit en C₆H₈O₇.
Dans l’ensemble, ces processus permettent la production à grande échelle de C₆H₈O₇ pour répondre à la demande dans diverses industries telles que l’alimentation et les boissons, les produits pharmaceutiques et les cosmétiques.
Utilisations de l’acide citrique
C₆H₈O₇ trouve de nombreuses applications dans diverses industries en raison de ses propriétés polyvalentes. Voici quelques utilisations courantes :
- Industrie alimentaire et des boissons : L’industrie alimentaire et des boissons utilise largement le C₆H₈O₇ comme exhausteur de goût, acidulant et conservateur dans les boissons gazeuses, les confitures, les bonbons et les produits laitiers.
- Industrie pharmaceutique : L’industrie pharmaceutique utilise C₆H₈O₇ comme ajusteur de pH et agent aromatisant dans la production de comprimés et de sirops effervescents. Il sert également d’agent chélateur dans certains médicaments.
- Produits de nettoyage : C₆H₈O₇ élimine efficacement le calcaire, les taches d’eau dure et la rouille, ce qui en fait un ingrédient courant dans les nettoyants ménagers, les détergents à vaisselle et les agents détartrants.
- Cosmétiques et soins personnels : C₆H₈O₇ joue de multiples rôles dans les produits de soins de la peau et des cheveux, servant d’ajusteur de pH, d’exfoliant et améliorant l’efficacité d’autres ingrédients.
- Traitement de l’eau : C₆H₈O₇ trouve une application dans les processus de traitement de l’eau pour contrôler les niveaux de pH et éliminer les ions métalliques. Il aide à prévenir la formation de tartre et à inhiber la croissance de certaines bactéries.
- Applications industrielles : Diverses industries utilisent du C₆H₈O₇ dans des processus tels que le nettoyage des métaux, la teinture des textiles et la catalyse de réactions chimiques.
- Photographie : En photographie, les développeurs utilisent C₆H₈O₇ pour développer des solutions pour les films photographiques. Il aide à contrôler le pH et améliore la qualité de l’image.
- Arôme et conservation des aliments : La saveur piquante de C₆H₈O₇ en fait un choix populaire comme agent acidifiant dans les produits alimentaires. De plus, il agit comme un conservateur naturel, prolongeant ainsi la durée de conservation de certains aliments.
Ces diverses applications mettent en évidence l’importance du C₆H₈O₇ dans de nombreuses industries, ce qui en fait un composé précieux et largement utilisé.
Des questions:
Q : Qu’est-ce que l’acide citrique ?
R : C₆H₈O₇ est un acide naturel présent dans les agrumes comme les citrons et les oranges, et il est largement utilisé dans diverses applications alimentaires et industrielles.
Q : L’acide citrique est-il un conservateur naturel ?
R : Oui, le C₆H₈O₇ est couramment utilisé comme conservateur naturel en raison de sa capacité à inhiber la croissance de certaines bactéries et à prolonger la durée de conservation des produits alimentaires.
Q : L’acide citrique est-il mauvais pour vous ?
R : C₆H₈O₇ est généralement reconnu comme étant sans danger pour une consommation en quantités modérées, mais une consommation excessive peut provoquer un inconfort gastro-intestinal ou une érosion dentaire.
Q : L’acide citrique et l’acide ascorbique sont-ils identiques ?
R : Non, le C₆H₈O₇ et l’acide ascorbique (vitamine C) sont des composés différents avec des structures et des propriétés chimiques distinctes, bien que les deux se trouvent couramment dans les fruits.
Q : L’acide citrique est-il dangereux ?
R : C₆H₈O₇ n’est pas intrinsèquement dangereux lorsqu’il est utilisé correctement, mais il peut provoquer une irritation des yeux et de la peau, et l’inhalation de grandes quantités de poussière ou de brouillard d’acide citrique peut irriter le système respiratoire.
Q : Où se produit le cycle de l’acide citrique ?
R : Le cycle C₆H₈O₇, également connu sous le nom de cycle de Krebs, se produit dans les mitochondries des cellules et joue un rôle central dans la respiration cellulaire, produisant des molécules riches en énergie.
Q : Lequel de ces éléments entre dans le cycle de l’acide citrique ?
R : L’acétyl-CoA, une molécule dérivée de la dégradation des glucides, des graisses et des protéines, entre dans le cycle C₆H₈O₇ pour être métabolisée davantage et générer de l’énergie.
Q : L’acide citrique est-il mauvais pour vous ?
R : C₆H₈O₇ est généralement sans danger pour une consommation modérée, mais une consommation excessive peut entraîner des effets indésirables, tels qu’un inconfort gastro-intestinal et une érosion de l’émail dentaire.
