L’acide chromique est un agent oxydant puissant et corrosif utilisé dans diverses applications, telles que le nettoyage des métaux, la gravure et dans certaines expériences en laboratoire. Il est de couleur rouge.
| Nom UICPA | Acide chromique |
| Formule moléculaire | H2CrO4 |
| Numero CAS | 7738-94-5 |
| Synonymes | Acide de chrome (VI), acide de chrome, dihydroxydioxydochrome, dihydrogène (tétraoxydochromate) |
| InChI | InChI=1S/Cr.H2O4/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
Propriétés de l’acide chromique
Formule d’acide chromique
La formule chimique de l’acide chrome est H2CrO4. Il se compose de deux atomes d’hydrogène, d’un atome de chrome et de quatre atomes d’oxygène. La formule représente la composition de l’acide chrome au niveau moléculaire.
Acide Chromique Masse molaire
La masse molaire de l’acide chrome peut être calculée en additionnant les masses atomiques de ses éléments constitutifs. Le chrome a une masse atomique de 51,996 grammes par mole, l’hydrogène a une masse molaire de 1,008 grammes par mole et l’oxygène a une masse molaire de 16,00 grammes par mole. Par conséquent, la masse molaire de l’acide chrome est d’environ 118,00 grammes par mole.
Point d’ébullition de l’acide chromique
L’acide de chrome n’a pas de point d’ébullition distinct car il se décompose lorsqu’il est chauffé, libérant de l’oxygène gazeux. Cependant, sa température de décomposition est d’environ 190°C (374°F). Lorsqu’il est chauffé, l’acide de chrome subit une réaction chimique qui entraîne la formation de trioxyde de chrome et d’eau.
Point de fusion de l’acide chromique
Le point de fusion de l’acide chrome n’est pas bien défini en raison de sa tendance à se décomposer avant de fondre. Cependant, on sait que l’acide de chrome peut se décomposer autour de 250°C (482°F) ou même à des températures plus basses, selon les conditions.
Densité d’acide chromique g/mL
L’acide de chrome a une densité d’environ 1,2 grammes par millilitre (g/mL) à température ambiante. Cette valeur de densité indique que l’acide de chrome est relativement dense par rapport à l’eau.
Acide Chromique Poids moléculaire
Le poids moléculaire de l’acide chrome est calculé en additionnant les masses atomiques de ses éléments constitutifs. Dans ce cas, le poids moléculaire est d’environ 118,00 grammes par mole.
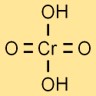
Structure de l’acide chromique
La structure de l’acide chrome est représentée par un atome central de chrome lié à quatre atomes d’oxygène et deux atomes d’hydrogène. Les atomes d’oxygène sont disposés autour de l’atome de chrome selon une forme tétraédrique.
Solubilité de l’acide chromique
L’acide de chrome est modérément soluble dans l’eau, ce qui signifie qu’il peut se dissoudre dans une certaine mesure. La solubilité augmente avec l’augmentation de la température. Il faut cependant le manipuler avec précaution car il s’agit d’une substance corrosive.
| Apparence | Cristaux rouge foncé |
| Gravité spécifique | 2,70 |
| Couleur | Rouge |
| Odeur | Inodore |
| Masse molaire | 118,01 g/mole |
| Densité | 1,201 g/ml |
| Point de fusion | Se décompose à ~190°C |
| Point d’ébullition | Se décompose à ~250°C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Soluble |
| Solubilité | Soluble dans l’eau et les solvants organiques tels que l’éthanol, l’éther |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | -0,64 |
| pH | Très acide (pH < 1) |
Sécurité et dangers de l’acide chromique
L’acide de chrome présente plusieurs risques pour la sécurité et doit être manipulé avec prudence. C’est une substance corrosive qui peut provoquer de graves brûlures à la peau, aux yeux et au système respiratoire au contact. L’inhalation de vapeurs ou de brouillards d’acide chrome peut irriter les voies respiratoires et entraîner de la toux, un essoufflement et des lésions pulmonaires. Il est également très toxique en cas d’ingestion, provoquant des douleurs abdominales, des vomissements et des lésions potentielles des organes. De plus, l’acide de chrome est un agent oxydant puissant et peut réagir violemment ou enflammer des substances inflammables. Un équipement de protection approprié, tel que des gants, des lunettes et une blouse de laboratoire, doit être porté lorsque vous travaillez avec de l’acide de chrome, et il doit être stocké et éliminé conformément aux règles de sécurité.
| Symboles de danger | Corrosif, Comburant |
| Description de la sécurité | – Provoque de graves brûlures – Peut intensifier l’incendie ; comburant – Nocif en cas d’ingestion – Provoque une irritation des voies respiratoires – Provoque des lésions oculaires – Peut provoquer des anomalies génétiques – Peut provoquer le cancer – Peut nuire à la fertilité ou au fœtus – Très toxique pour la vie aquatique – À manipuler et à éliminer correctement |
| Numéros d’identification de l’ONU | UN1755, UN1463 |
| Code SH | 28191000 |
| Classe de danger | 8 (Corrosif) |
| Groupe d’emballage | II (Intermédiaire) |
| Toxicité | Très toxique et nocif |
Méthodes de synthèse de l’acide chromique
Il existe plusieurs méthodes de synthèse de l’acide chrome.
Une méthode courante implique la réaction entre le dichromate de sodium (Na2Cr2O7) et l’acide sulfurique (H2SO4) . Dans ce processus, vous ajoutez lentement du bichromate de sodium à l’acide sulfurique tout en remuant. La réaction se déroule pour former de l’acide de chrome (H2CrO4) et du sulfate de sodium (Na2SO4) comme sous-produit. La solution d’acide de chrome résultante peut être purifiée et concentrée en éliminant l’excès d’eau.
Semblable à la méthode précédente, nous pouvons ajouter du chromate de potassium à l’acide sulfurique , entraînant la formation d’acide de chrome et de sulfate de potassium (K2SO4) comme sous-produit.
Alternativement, vous pouvez préparer de l’acide de chrome en faisant réagir du trioxyde de chrome (CrO3) avec de l’eau. Vous dissolvez le trioxyde de chrome dans l’eau, ce qui entraîne la formation d’une solution d’acide chrome.
N’oubliez pas que l’acide chrome est une substance hautement corrosive et dangereuse. Par conséquent, il convient d’effectuer sa synthèse avec les précautions de sécurité appropriées et dans un endroit bien ventilé. Portez des équipements de protection, tels que des gants, des lunettes et une blouse de laboratoire, pendant le processus de synthèse. Suivez également les méthodes d’élimination appropriées pour garantir la manipulation et l’élimination en toute sécurité de tout déchet généré lors de la synthèse.
Utilisations de l’acide chromique
L’acide de chrome trouve diverses applications en raison de ses propriétés de puissant agent oxydant. Voici quelques utilisations courantes :
- Nettoyage des métaux : l’acide de chrome élimine efficacement la rouille, le tartre et les dépôts organiques des surfaces métalliques, nettoyant et éliminant les contaminants de surface.
- Gravure : L’acide de chrome crée des motifs et des dessins fins sur des surfaces, telles que le verre, la céramique et les métaux, les grave et le rend utile dans la production de verrerie décorative et la fabrication de circuits électroniques.
- Préparation de surface : les processus industriels utilisent de l’acide de chrome pour préparer les surfaces à peindre, à recouvrir ou à coller, garantissant ainsi une bonne adhérence en éliminant les impuretés et en créant une surface propre.
- Chimie analytique : les chimistes et les laboratoires utilisent l’acide de chrome comme agent oxydant dans les analyses chimiques et les expériences en laboratoire, déterminant les concentrations de certains composés organiques.
- Préservation du bois : L’acide de chrome agit comme un agent de préservation du bois, pénétrant profondément dans les fibres du bois pour le protéger contre la pourriture, les infestations d’insectes et les intempéries.
- Industrie textile : L’industrie textile utilise l’acide de chrome pour les processus de teinture et d’impression, fixant les colorants dans les tissus et améliorant la solidité des couleurs.
- Photographie : L’acide de chrome joue un rôle dans certains processus photographiques, notamment la production de tirages couleur et de films inversibles couleur.
- Galvanoplastie : Dans les processus de galvanoplastie, en particulier pour le chromage, l’acide de chrome sert de source d’ions chrome qui se déposent sur les surfaces métalliques, fournissant ainsi un revêtement protecteur et décoratif.
Il est important de noter que l’acide de chrome est une substance dangereuse et que des précautions de sécurité appropriées doivent être prises lors de sa manipulation, de son stockage et de son élimination.
Des questions:
Q : Que se passe-t-il lorsque le phénol est oxydé avec de l’acide chromique ?
R : Le phénol subit une oxydation avec l’acide de chrome, entraînant la formation de quinones et d’eau.
Q : Comment préparer l’acide chromique ?
R : L’acide de chrome peut être préparé en faisant réagir du dichromate de sodium ou du chromate de potassium avec de l’acide sulfurique.
Q : Comment fabriquer de l’acide chromique ?
R : L’acide de chrome peut être fabriqué en mélangeant un composé de chrome (tel que le trioxyde de chrome) avec de l’eau.
Q : Qu’est-ce que l’acide chromique ?
R : L’acide de chrome est un agent oxydant puissant et corrosif composé de chrome, d’hydrogène et d’oxygène.
Q : L’acide chromique réduit-il les alcènes ?
R : Non, l’acide chrome est un agent oxydant et n’a pas de propriétés réductrices.
Q : Comment préparer l’acide chromique pour nettoyer la verrerie de laboratoire ?
R : Une solution de nettoyage à l’acide de chrome peut être préparée en dissolvant du trioxyde de chrome dans de l’eau et en ajoutant de l’acide sulfurique.
Q : L’acide chromique est-il un acide fort ?
R : Oui, l’acide de chrome est considéré comme un acide fort en raison de sa capacité à donner des protons.
Q : Comment préparer une solution de nettoyage à l’acide chromique ?
R : Pour préparer une solution de nettoyage à l’acide de chrome, dissolvez le trioxyde de chrome dans l’eau et ajoutez une petite quantité d’acide sulfurique.
Q : Lequel des alcools suivants donnera un test d’acide chromique positif ?
R : Les alcools primaires peuvent donner un test d’acide chrome positif, produisant un changement de couleur de l’orange au vert ou au bleu.
