L’acide chlorosulfonique est un acide fort de formule HSO₃Cl. Il est très corrosif, utilisé comme réactif en synthèse organique et comme agent sulfonant pour la fabrication de détergents et de colorants.
| Nom de l’UICPA | Acide chlorosulfonique |
| Formule moléculaire | HSO₃Cl |
| Numero CAS | 7790-94-5 |
| Synonymes | Chlorhydrine sulfurique, acide chlorosulfurique, acide chlorosulfonique |
| InChI | InChI=1S/ClHO3S/c1-5(2,3)4/h(H,2,3,4) |
Propriétés de l’acide chlorosulfonique
Formule d’acide chlorosulfonique
La formule de l’acide chlorosulfonique est HSO₃Cl. Il se compose d’un atome d’hydrogène, d’un atome de soufre, de trois atomes d’oxygène et d’un atome de chlore.
Acide Chlorosulfonique Masse molaire
La masse molaire de l’acide chlorosulfurique est calculée en additionnant les masses atomiques de ses atomes constitutifs. La masse molaire de HSO₃Cl est d’environ 116,5 grammes par mole.
Point d’ébullition de l’acide chlorosulfonique
Le point d’ébullition de l’acide chlorosulfurique est relativement élevé. Il fait environ 151 degrés Celsius (304 degrés Fahrenheit). À cette température, l’acide chlorosulfurique passe d’une phase liquide à une phase gazeuse.
Acide chlorosulfonique Point de fusion
L’acide chlorosulfurique a un point de fusion d’environ -82 degrés Celsius (-116 degrés Fahrenheit). C’est la température à laquelle la forme solide de l’acide chlorosulfurique se transforme en liquide.
Densité de l’acide chlorosulfonique g/mL
L’acide chlorosulfurique a une densité d’environ 1,75 grammes par millilitre (g/mL) à température ambiante. Cela signifie qu’un volume donné d’acide chlorosulfurique est relativement lourd par rapport à un volume égal d’eau.
Acide Chlorosulfonique Poids moléculaire
Le poids moléculaire de l’acide chlorosulfurique est calculé en additionnant les poids atomiques de tous les atomes de sa formule chimique. L’acide chlorosulfurique a un poids moléculaire d’environ 116,5 grammes par mole.
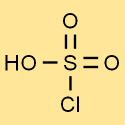
Structure de l’acide chlorosulfonique
La structure de l’acide chlorosulfurique est constituée d’un atome de soufre lié à trois atomes d’oxygène et à un atome de chlore. L’atome d’hydrogène est attaché à l’un des atomes d’oxygène. Cette structure confère à l’acide chlorosulfurique ses propriétés et sa réactivité uniques.
Solubilité de l’acide chlorosulfonique
L’acide chlorosulfurique est très soluble dans l’eau. Il se dissout facilement dans l’eau, formant une solution fortement acide. La solubilité de l’acide chlorosulfurique est due à sa nature polaire et à la formation de liaisons hydrogène avec les molécules d’eau.
| Apparence | Liquide incolore à jaune |
| Gravité spécifique | 1,75 (à 20°C) |
| Couleur | Incolore à jaune |
| Odeur | Odeur forte et âcre |
| Masse molaire | 116,5 g/mole |
| Densité | 1,75 g/mL (à 20°C) |
| Point de fusion | -82°C (-116°F) |
| Point d’ébullition | 151°C (304°F) |
| Point d’éclair | Pas disponible |
| Solubilité dans l’eau | Miscible |
| Solubilité | Soluble dans les solvants organiques tels que le chloroforme, le dichlorométhane, le nitrobenzène |
| Pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | -2,6 |
| pH | Très acide (pH < 1) |
Remarque : Veuillez garder à l’esprit que les valeurs fournies dans ce tableau sont des propriétés générales associées à l’acide chlorosulfurique. Les valeurs réelles peuvent varier légèrement en fonction des conditions spécifiques et de la pureté du composé.
Sécurité et dangers de l’acide chlorosulfonique
L’acide chlorosulfurique présente des risques importants pour la sécurité et doit être manipulé avec une extrême prudence. Il est très corrosif et peut provoquer de graves brûlures au contact de la peau, des yeux et du système respiratoire. L’inhalation ou l’ingestion peut entraîner de graves risques pour la santé, notamment une détresse respiratoire et des dommages aux organes internes. Il réagit violemment avec l’eau, libérant des gaz toxiques et générant de la chaleur. Des risques d’incendie et d’explosion existent au contact de matières organiques. Un équipement de protection individuelle adéquat, tel que des gants, des lunettes et un respirateur, doit être utilisé lorsque vous travaillez avec de l’acide chlorosulfurique. Des mesures de ventilation et de confinement appropriées sont cruciales pour minimiser l’exposition et garantir la sécurité lors de la manipulation de cette substance dangereuse.
| Symboles de danger | Corrosif (C), Nocif (Xn) |
| Description de la sécurité | – Manipuler avec une extrême prudence\n- Utiliser un équipement de protection approprié\n- Éviter tout contact avec la peau, les yeux et l’inhalation\n- Conserver dans un endroit bien ventilé\n- Ne pas mélanger avec de l’eau ou des substances réactives |
| Numéros d’identification de l’ONU | ONU 1751 |
| Code SH | 28121100 |
| Classe de danger | Classe 8 – Substances corrosives |
| Groupe d’emballage | Groupe d’emballage II |
| Toxicité | Très toxique ; provoque de graves brûlures et des lésions respiratoires |
Méthodes de synthèse de l’acide chlorosulfonique
Il existe plusieurs méthodes de synthèse de l’acide chlorosulfurique. Une méthode courante implique la réaction entre le trioxyde de soufre (SO₃) et le chlorure d’hydrogène (HCl) . Dans ce processus, la solution de HCl subit un barbotage avec du gaz SO₃ pour générer de l’acide chlorosulfurique. Un contrôle minutieux de la température et des conditions de réaction est nécessaire en raison de la forte exothermicité de la réaction.
Dans une autre méthode, la réaction du chlore gazeux (Cl₂) avec l’acide sulfurique (H₂SO₄) produit de l’acide chlorosulfurique. Le passage du chlore gazeux à travers l’acide sulfurique concentré entraîne la formation d’acide chlorosulfurique. Pour garantir la sécurité, vous devez prendre les mesures appropriées face à cette réaction exothermique.
De plus, la préparation de l’acide chlorosulfurique implique la réaction de l’acide sulfurique avec le chlorure de sulfuryle (SO₂Cl₂). Le chlorure de sulfuryle réagit avec l’acide sulfurique pour former de l’acide chlorosulfurique et du chlorure d’hydrogène gazeux.
Il convient de noter que la synthèse de l’acide chlorosulfurique doit être effectuée dans un laboratoire bien équipé, en suivant des protocoles de sécurité appropriés. Le chimiste doit utiliser des équipements de protection, tels que des gants, des lunettes et une hotte, pour assurer sa sécurité.
Ces méthodes de synthèse permettent aux chimistes de produire de l’acide chlorosulfurique, un composé polyvalent utilisé dans diverses applications industrielles, notamment la synthèse organique, les réactions de sulfonation et la production de colorants et de détergents.
Utilisations de l’acide chlorosulfonique
L’acide chlorosulfurique trouve de nombreuses applications dans diverses industries en raison de ses propriétés polyvalentes. Voici quelques-unes de ses utilisations :
- L’acide chlorosulfurique participe activement à diverses réactions de synthèse organique, notamment les estérifications, les sulfonations et les halogénations, en servant de réactif puissant. Il introduit efficacement des groupes fonctionnels et modifie les structures moléculaires.
- Dans la fabrication des colorants, l’acide chlorosulfurique joue un rôle crucial car il sulfone activement les composés aromatiques, permettant ainsi la création de groupes acide sulfonique. Ces groupes améliorent la solubilité des colorants et améliorent les propriétés de la couleur.
- Dans la production de détergents, l’acide chlorosulfurique fonctionne activement comme agent sulfonant lors de la synthèse des composés détergents. Il contribue activement à la formation de tensioactifs, améliorant leurs propriétés nettoyantes et moussantes.
- L’industrie pharmaceutique utilise largement l’acide chlorosulfurique comme composant actif dans la recherche et la fabrication. Il introduit activement des groupes sulfamides dans les molécules médicamenteuses, ce qui a un impact significatif sur leurs propriétés pharmacologiques.
- Les réactions de polymérisation utilisent activement l’acide chlorosulfurique comme catalyseurs ou initiateurs pour la synthèse de polymères spéciaux. Ces polymères trouvent activement des applications dans diverses industries, telles que les revêtements, les adhésifs et l’isolation électrique.
- Il sert d’intermédiaire important dans la production de divers produits chimiques, notamment les acides sulfoniques, les esters d’acide sulfurique et les chlorosulfonates. Ces composés trouvent des applications dans diverses industries telles que les produits pharmaceutiques, agrochimiques et la fabrication de polymères.
- En laboratoire, les chercheurs utilisent activement l’acide chlorosulfurique comme réactif pour diverses réactions chimiques, telles que les réactions d’estérification, d’acylation et de déshydratation.
Il est important de manipuler l’acide chlorosulfurique avec prudence en raison de sa nature corrosive et de ses risques potentiels pour la santé.
Des questions:
Q : Comment créer du chlorure d’acétamidobenzènesulfonyle à partir d’acétanilide et d’acide chlorosulfonique ?
R : Le chlorure d’acétamidobenzènesulfonyle est formé en traitant l’acétanilide avec de l’acide chlorosulfurique, entraînant la substitution du groupe amino par le groupe chlorure de sulfonyle.
Q : Comment utiliser l’acide chlorosulfonique ?
R : L’acide chlorosulfurique est utilisé comme réactif dans diverses réactions chimiques, telles que la sulfonation, l’estérification et l’acylation, pour introduire des groupes fonctionnels ou modifier des structures moléculaires.
Q : L’acide chlorosulfonique est-il un bon groupe partant ?
R : Oui, l’acide chlorosulfurique est un bon groupe partant en raison de la stabilité du groupe acide sulfonique et de sa capacité à subir des réactions de substitution.
Q : Comment éliminer l’acide chlorosulfonique ?
R : L’acide chlorosulfurique doit être neutralisé avec une base, telle que le carbonate de sodium, puis dilué avec de l’eau et soigneusement éliminé conformément aux réglementations locales.
Q : Que se passe-t-il lorsque l’acide chlorosulfonique entre en contact avec de l’eau ?
R : Lorsque l’acide chlorosulfurique entre en contact avec l’eau, il réagit vigoureusement en libérant de la chaleur et des gaz toxiques, tels que le dioxyde de soufre et le chlorure d’hydrogène.
Q : Le laurylsulfate de sodium peut être préparé en remplaçant l’acide chlorosulfonique par un autre réactif ?
R : Oui, le laurylsulfate de sodium peut être synthétisé en remplaçant l’acide chlorosulfurique par de l’acide sulfurique dans la réaction avec l’alcool laurique, suivi d’une neutralisation avec de l’hydroxyde de sodium.
Q : Quelle est la densité de l’acide chlorosulfonique ?
R : La densité de l’acide chlorosulfurique est d’environ 1,75 g/mL à température ambiante.
Q : Combien de moles d’acide chlorosulfonique sont nécessaires pour produire une mole de chlorure d’acétamidobenzènesulfonyle ?
R : Une mole de chlorure d’acétamidobenzènesulfonyle peut être obtenue en faisant réagir une mole d’acétanilide avec une mole d’acide chlorosulfurique.
Q : L’acide chlorosulfonique peut-il être stocké avec des oxydants ?
R : Non, l’acide chlorosulfurique doit être stocké séparément des comburants, car il peut réagir violemment ou augmenter le risque d’incendie lorsqu’il est en contact avec des substances comburantes.
