L’acide chloroacétique est un composé chimique de formule CH₂ClCOOH. Il est utilisé dans diverses applications industrielles, notamment la production de colorants, de produits pharmaceutiques et d’herbicides.
| Nom UICPA | Acide chloroacétique |
| Formule moléculaire | CH₂ClCOOH |
| Numero CAS | 79-11-8 |
| Synonymes | Acide monochloroacétique, MCA, acide chloroéthanoïque, acide chloroéthylique |
| InChI | InChI=1S/C2H3ClO2/c3-1-2(4)5/h1H2,(H,4,5) |
Propriétés de l’acide chloroacétique
Formule d’acide chloroacétique
La formule de l’acide chloroacétique est CH₂ClCOOH. Il se compose de deux atomes de carbone, trois atomes d’hydrogène, un atome de chlore et deux atomes d’oxygène. L’atome de chlore est lié à l’un des atomes de carbone, tandis que l’autre atome de carbone est lié au groupe acide carboxylique (-COOH).
Acide Chloroacétique Masse molaire
La masse molaire de l’acide monochloroacétique est calculée en additionnant les masses atomiques de ses éléments constitutifs. L’acide monochloroacétique a une masse molaire d’environ 94,5 grammes par mole. Elle est déterminée en considérant les masses atomiques de carbone (C), d’hydrogène (H), de chlore (Cl) et d’oxygène (O) présentes dans le composé.
Point d’ébullition de l’acide chloroacétique
L’acide monochloroacétique a un point d’ébullition d’environ 189 degrés Celsius. A cette température, l’acide monochloroacétique liquide se transforme en phase gazeuse. Le point d’ébullition de l’acide monochloroacétique est influencé par les forces intermoléculaires entre ses molécules et la pression atmosphérique.
Acide chloroacétique Point de fusion
Le point de fusion de l’acide monochloroacétique est d’environ 62 degrés Celsius. C’est la température à laquelle la forme solide de l’acide monochloroacétique passe à l’état liquide. Le point de fusion peut varier légèrement en fonction de la pureté de l’échantillon et des conditions dans lesquelles il est mesuré.
Densité de l’acide chloroacétique g/mL
La densité de l’acide monochloroacétique est d’environ 1,58 grammes par millilitre. Il indique la masse d’acide monochloroacétique par unité de volume. La densité de l’acide monochloroacétique est influencée par des facteurs tels que la température et la pression.
Acide Chloroacétique Poids moléculaire
Le poids moléculaire de l’acide monochloroacétique est d’environ 94,5 grammes par mole. Il représente la somme des poids atomiques de tous les atomes d’une molécule d’acide monochloroacétique. Le poids moléculaire est utile dans divers calculs impliquant le composé, tels que la détermination de concentrations ou de quantités molaires.
Structure de l’acide chloroacétique
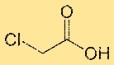
L’acide monochloroacétique a une structure constituée d’un atome de carbone central lié à un atome de chlore, d’un groupe acide carboxylique (-COOH) et de deux atomes d’hydrogène. L’atome de chlore est directement lié à l’atome de carbone. La disposition structurelle de l’acide monochloroacétique influence ses propriétés chimiques et sa réactivité.
Solubilité de l’acide chloroacétique
L’acide monochloroacétique est modérément soluble dans l’eau. Il forme des liaisons hydrogène avec les molécules d’eau, lui permettant de se dissoudre dans une certaine mesure. La solubilité de l’acide monochloroacétique est influencée par des facteurs tels que la température, le pH et la présence d’autres substances dans la solution.
| Apparence | Liquide incolore |
| Gravité spécifique | 1,58 g/ml |
| Couleur | Incolore |
| Odeur | Vinaigré |
| Masse molaire | 94,5 g/mole |
| Densité | 1,58 g/ml |
| Point de fusion | 62 °C |
| Point d’ébullition | 189 °C |
| Point d’éclair | 111 °C |
| Solubilité dans l’eau | Miscible |
| Solubilité | Soluble dans l’éthanol, l’éther, le chloroforme |
| Pression de vapeur | 0,23 mmHg à 25 °C |
| Densité de vapeur | 3,3 (air = 1) |
| pKa | 2,87 |
| pH | 1,5 – 2,5 |
Sécurité et dangers de l’acide chloroacétique
L’acide monochloroacétique présente plusieurs risques pour la sécurité et doit être manipulé avec prudence. Il est corrosif pour la peau, les yeux et le système respiratoire, provoquant des brûlures et des irritations. Un contact direct peut entraîner de graves lésions cutanées et oculaires. L’inhalation de ses vapeurs ou brouillards peut irriter les voies respiratoires. Il est également nocif en cas d’ingestion, entraînant des troubles gastro-intestinaux. Un équipement de protection individuelle approprié, tel que des gants et des lunettes, doit être porté lorsque vous travaillez avec de l’acide monochloroacétique. Une ventilation adéquate est cruciale pour minimiser l’exposition. En cas de contact avec la peau ou les yeux, un rinçage immédiat à l’eau est indispensable et des soins médicaux doivent être recherchés.
| Symboles de danger | Corrosif, Toxique |
| Description de la sécurité | Évitez les contacts. Utilisez un équipement de protection individuelle. Assurer une ventilation adéquate. Manipuler avec soin. |
| Numéros d’identification de l’ONU | ONU 1751 |
| Code SH | 2915.12.00 |
| Classe de danger | 8 (Corrosif) |
| Groupe d’emballage | II |
| Toxicité | Toxique par ingestion, inhalation et absorption cutanée. Provoque de graves brûlures et des lésions oculaires. Nocif en cas d’ingestion. |
Méthodes de synthèse de l’acide chloroacétique
Diverses méthodes permettent la synthèse de l’acide monochloroacétique.
Une méthode couramment utilisée pour synthétiser l’acide monochloroacétique consiste à traiter l’acide acétique avec un agent halogénant, généralement du chlore gazeux (Cl₂), en présence d’un catalyseur tel que l’acide sulfurique (H₂SO₄). La réaction entre l’acide acétique et le chlore entraîne la substitution d’un atome d’hydrogène dans la molécule d’acide acétique par un atome de chlore, formant ainsi de l’acide monochloroacétique.
Une autre méthode implique la réaction entre le chlorure d’acétyle (CH₃COCl) et l’eau (H₂O). L’eau hydrolyse le chlorure d’acétyle, conduisant à la formation d’acide monochloroacétique. Cette réaction est exothermique et nécessite de la prudence lors de son exécution.
La formation d’acide monochloroacétique se produit par la carboxylation du chlorométhane (CH₃Cl) en utilisant du dioxyde de carbone (CO₂) en présence d’une base robuste comme l’hydroxyde de sodium (NaOH) . La réaction se déroule par substitution nucléophile, où le groupe carboxylate (-COOH) de la molécule de dioxyde de carbone remplace l’ion chlorure.
N’oubliez pas qu’une manipulation appropriée et des précautions de sécurité sont cruciales pour ces méthodes de synthèse en raison de la nature corrosive et toxique de l’acide monochloroacétique. Assurer un contrôle minutieux des conditions de réaction et une élimination appropriée des sous-produits et des déchets pour garantir des processus de synthèse sûrs et efficaces.
Utilisations de l’acide chloroacétique
L’acide monochloroacétique trouve des applications dans diverses industries en raison de ses propriétés polyvalentes. Voici quelques utilisations courantes :
- Production d’herbicides : L’acide monochloroacétique est un ingrédient essentiel dans la synthèse des herbicides, comme le glyphosate. Il aide à inhiber la croissance des plantes et des mauvaises herbes indésirables en agriculture.
- Fabrication de produits pharmaceutiques : elle sert d’élément de base dans la production de composés pharmaceutiques, notamment d’antibiotiques, d’antiseptiques et d’analgésiques. L’acide monochloroacétique aide à modifier et à améliorer les propriétés souhaitées de ces médicaments.
- Industrie des colorants et des pigments : les fabricants utilisent de l’acide monochloroacétique dans la production de colorants et de pigments. Il aide à la synthèse des colorants utilisés dans les textiles, les peintures, les encres et autres applications décoratives.
- Intermédiaires chimiques : Il agit comme composé intermédiaire clé dans la production de divers produits chimiques. La synthèse de polymères, de solvants, de plastifiants et d’autres composés organiques implique l’utilisation de ces intermédiaires.
- Fabrication de tensioactifs : L’acide monochloroacétique joue un rôle dans la production de tensioactifs, qui sont des composants essentiels des détergents, des agents de nettoyage et des produits de soins personnels. Les tensioactifs aident à réduire la tension superficielle entre les liquides, permettant ainsi de meilleures capacités de mélange et de dispersion.
- Applications de recherche et de laboratoire : Les laboratoires de recherche utilisent l’acide monochloroacétique comme réactif pour les réactions chimiques, en particulier dans les procédures de synthèse organique et d’analyse.
- Réactions chimiques et synthèse organique : Il sert de réactif important dans diverses réactions organiques, telles que les substitutions nucléophiles, les estérifications et les réactions de carboxylation.
- Galvanoplastie : L’acide monochloroacétique trouve une application dans les processus de galvanoplastie, où il agit comme source de chlore pour le dépôt de revêtements métalliques sur les surfaces.
Ces diverses applications mettent en évidence l’importance de l’acide monochloroacétique dans toutes les industries, contribuant au développement de nombreux produits et procédés chimiques.
Des questions:
Q : Quelle est la valeur de Ka pour une solution 0,15 M d’acide chloroacétique avec un pH de 1,86 ?
R : La valeur Ka de l’acide monochloroacétique peut être calculée à l’aide de la valeur du pH et elle est d’environ 1,4 x 10^-3.
Q : L’acide chloroacétique est-il fort ou faible ?
R : L’acide monochloroacétique est un acide faible.
Q : Que donnent le 4-chlorophénolate de sodium + l’acide chloroacétique ?
R : La réaction du 4-chlorophénolate de sodium avec l’acide monochloroacétique donne de l’acide 4-chlorophénoxyacétique et du chlorure de sodium.
Q : Quel est le Ka de l’acide chloroacétique ?
R : La valeur Ka de l’acide monochloroacétique est d’environ 1,4 x 10^-3.
Q : L’acide chloroacétique est-il monoprotique ?
R : Oui, l’acide monochloroacétique est monoprotique, ce qui signifie qu’il ne peut céder qu’un seul proton (ion H+) dans une réaction chimique.
Q : Quelle est la constante d’ionisation de l’acide chloroacétique ?
R : La constante d’ionisation (Ka) de l’acide monochloroacétique est d’environ 1,4 x 10^-3.
Q : L’acide chloroacétique est-il plus fort que l’acide acétique ?
R : Oui, l’acide monochloroacétique est plus fort que l’acide acétique.
Q : Pourquoi l’acide chloroacétique est-il plus fort que l’acide acétique ?
R : La présence de l’atome de chlore dans l’acide monochloroacétique augmente sa capacité d’attraction d’électrons, le rendant plus acide que l’acide acétique.
Q : Quelle est la masse molaire de l’acide chloroacétique ?
R : La masse molaire de l’acide monochloroacétique est d’environ 94,5 grammes par mole.
