L’acide chlorique (HClO3) est un acide fort et instable qui peut être produit en mélangeant du dioxyde de chlore avec de l’eau. Il est utilisé dans les agents de blanchiment et de désinfection, ainsi que dans la production d’explosifs.
| Nom UICPA | Acide chlorique |
| Formule moléculaire | HClO3 |
| Numero CAS | 7790-93-4 |
| Synonymes | Acide perchlorique, chlorate ; Solution d’acide chlorique ; Acide chlorique (V); Chlorate d’hydrogène ; Trichlorate d’hydrogène |
| InChI | InChI=1S/ClHO3/c2-1(3)4/h(H,2,3,4) |
Les propriétés de l’acide chlorique (HClO3) intéressent particulièrement les chimistes et les ingénieurs en raison de ses nombreuses applications industrielles.
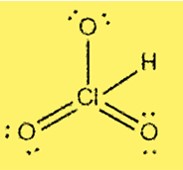
Structure de Lewis HClO3
La structure de Lewis de HClO3 montre que le chlore est l’atome central lié à trois atomes d’oxygène et à un atome d’hydrogène. Le chlore possède 7 électrons de valence et chaque oxygène possède 6 électrons de valence. La structure comprend trois liaisons simples et une double liaison entre les atomes de chlore et d’oxygène.
Formule d’acide chlorique (HClO3)
La formule chimique de l’acide chlorique (HClO3) est HClO3. C’est un acide inorganique qui contient un atome de chlore, un atome d’hydrogène et trois atomes d’oxygène. La formule de l’acide chlorique (HClO3) est utilisée pour calculer la stœchiométrie et la concentration des solutions contenant l’acide.
Acide chlorique (HClO3) masse molaire
La masse molaire de l’acide chlorique (HClO3) est 84,46 g/mol. C’est un acide relativement léger comparé à d’autres acides inorganiques, comme l’acide sulfurique, qui a une masse molaire de 98,08 g/mol. La masse molaire de l’acide chlorique (HClO3) est un paramètre important dans le calcul de la concentration et de la stœchiométrie des solutions contenant l’acide.
Point d’ébullition de l’acide chlorique (HClO3)
L’acide chlorique (HClO3) a un point d’ébullition de 40,5°C. C’est un acide très volatil qui peut se décomposer à haute température, ce qui rend sa manipulation et son stockage difficiles. Le faible point d’ébullition de l’acide chlorique (HClO3) est une considération importante dans la conception d’équipements et de processus impliquant l’utilisation de l’acide.
Point de fusion de l’acide chlorique (HClO3)
L’acide chlorique (HClO3) n’a pas de point de fusion bien défini. Il peut se décomposer avant d’atteindre son point de fusion, libérant de l’oxygène gazeux et laissant derrière lui un résidu de chlorates. L’absence de point de fusion distinct est due à l’instabilité de l’acide chlorique (HClO3).
Densité de l’acide chlorique (HClO3) g/ml
La densité de l’acide chlorique (HClO3) est de 1,97 g/cm³. C’est un acide relativement dense comparé à d’autres acides inorganiques, comme l’acide chlorhydrique, qui a une densité de 1,18 g/cm³. La haute densité de l’acide chlorique (HClO3) est une considération importante dans la conception de processus impliquant la manipulation et le transport de l’acide.
Poids moléculaire de l’acide chlorique (HClO3)
Le poids moléculaire de l’acide chlorique (HClO3) est de 84,46 g/mol. C’est la somme des poids atomiques de ses éléments constitutifs : un atome de chlore, un atome d’hydrogène et trois atomes d’oxygène. Le poids moléculaire de l’acide chlorique (HClO3) est un paramètre important dans le calcul de la concentration et de la stœchiométrie des solutions contenant l’acide.
Structure de l’acide chlorique (HClO3)
La structure de l’acide chlorique est composée d’un atome de chlore central lié à trois atomes d’oxygène et un atome d’hydrogène. La molécule a une géométrie tétraédrique, avec l’atome de chlore au centre du tétraèdre. Les trois atomes d’oxygène sont disposés autour de l’atome de chlore selon une disposition planaire trigonale, tandis que l’atome d’hydrogène est lié à l’un des atomes d’oxygène. La structure de l’acide chlorique (HClO3) est importante pour comprendre ses propriétés chimiques et sa réactivité.
| Apparence | Liquide clair ou jaunâtre |
| Gravité spécifique | 1,97 |
| Couleur | Incolore à jaune |
| Odeur | Inodore |
| Masse molaire | 84,46 g/mole |
| Densité | 1,68 g/cm³ |
| Point de fusion | Se décompose avant de fondre |
| Point d’ébullition | 40,5°C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Miscible |
| Solubilité | Soluble dans la plupart des solvants organiques |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| PKa | -0,6 |
| PH | <1 |
Acide chlorique (HClO3) Sécurité et dangers
L’acide chlorique (HClO3) présente plusieurs risques pour la sécurité et doit être manipulé avec précaution. C’est un oxydant puissant qui peut réagir violemment avec de nombreuses matières organiques, notamment les carburants, les agents réducteurs et les liquides inflammables. Il peut provoquer de graves brûlures à la peau et aux yeux au contact et peut être corrosif pour les surfaces métalliques. L’inhalation de ses vapeurs peut provoquer une irritation respiratoire et de la toux. En raison de sa nature réactive, il doit être stocké et manipulé dans un endroit bien ventilé, à l’écart des autres produits chimiques. Des équipements de protection, tels que des gants, des lunettes et un respirateur, doivent être portés lors de la manipulation de l’acide chlorique pour éviter toute exposition. En cas de contact cutané ou oculaire, des soins médicaux immédiats doivent être recherchés.
| Symboles de danger | Agent d’oxydation |
| Description de la sécurité | Eviter le contact avec la peau et les yeux; porter un équipement de protection |
| Identifiants ONU | ONU 3084 |
| Code SH | 2811.19 |
| Classe de danger | 5.1 |
| Groupe d’emballage | II |
| Toxicité | Corrosif; peut provoquer de graves brûlures à la peau et aux yeux |
Méthodes de synthèse de l’acide chlorique (HClO3)
L’acide chlorique peut être synthétisé par plusieurs méthodes, notamment la réaction du chlore gazeux avec l’hydroxyde de sodium ou le chlorate de sodium. Une méthode courante est la réaction du chlorate de sodium avec l’acide chlorhydrique.
La réaction de synthèse de l’acide chlorique implique la réaction du chlorate de sodium (NaClO3) avec l’acide chlorhydrique (HCl) dans un processus en deux étapes. La première étape implique la conversion du chlorate de sodium en chlorite de sodium (NaClO2) et en dioxyde de chlore (ClO2) gazeux en présence d’un catalyseur acide. Dans la deuxième étape, le dioxyde de chlore gazeux réagit avec l’excès d’acide chlorhydrique pour former de l’acide chlorique et du chlore gazeux.
Une autre méthode de synthèse de l’acide chlorique implique l’électrolyse d’une solution contenant du chlorure de sodium, de l’acide nitrique et de l’acide sulfurique. Ce processus produit du chlore gazeux qui réagit avec l’eau pour former de l’acide chlorique.
Pour produire de l’acide chlorique, on peut faire réagir du chlorate de potassium avec de l’acide sulfurique puis distiller le mélange obtenu.
La synthèse de l’acide chlorique nécessite une manipulation prudente des réactifs en raison du risque de réactions violentes et de la nature corrosive des acides impliqués. Il est important de suivre les protocoles de sécurité appropriés et de manipuler les matériaux dans un endroit bien ventilé en utilisant un équipement de protection approprié.
Utilisations de l’acide chlorique (HClO3)
L’acide chlorique (HClO3) a plusieurs applications dans diverses industries en raison de ses fortes propriétés oxydantes. Certaines de ses utilisations sont :
- Production d’autres produits chimiques : L’acide chlorique sert d’intermédiaire dans la production d’autres produits chimiques, notamment l’acide perchlorique, les chlorates et les perchlorates.
- Agent de blanchiment : L’industrie des pâtes et papiers utilise l’acide chlorique comme agent de blanchiment.
- Désinfectant : L’acide chlorique agit comme désinfectant dans l’industrie alimentaire et des boissons pour désinfecter les équipements et les surfaces.
- Agent de gravure : L’industrie des semi-conducteurs utilise l’acide chlorique comme agent de gravure pour éliminer les couches de matériaux indésirables des plaquettes semi-conductrices.
- Réactif de laboratoire : L’acide chlorique est utilisé comme réactif de laboratoire en chimie analytique et en synthèse organique.
- Agent oxydant : L’acide chlorique est utilisé comme agent oxydant dans les réactions de chimie organique.
- Propulseur de fusée : L’acide chlorique sert d’oxydant dans les propulseurs de fusée.
- Traitement de l’eau : L’acide chlorique est utilisé dans le traitement de l’eau pour contrôler la croissance des algues et des bactéries.
Des questions:
Q : L’acide chlorique est-il un acide fort ?
R : Oui, l’acide chlorique (HClO3) est un acide fort.
Q : Quelle formule représente l’acide chlorique ?
R : La formule de l’acide chlorique est HClO3.
Q : Expliquez pourquoi HCl est de l’acide chlorhydrique et HClO3 est de l’acide chlorique ?
R : Les noms des acides binaires (composés qui ne contiennent que deux éléments) sont généralement dérivés du nom de l’anion, avec le suffixe -ic pour l’anion le plus courant et -ous pour le moins courant. Dans le cas du HCl, l’anion est le chlorure (Cl-), l’acide est donc appelé acide chlorhydrique. Dans le cas de HClO3, l’anion est le chlorate (ClO3-), l’acide est donc appelé acide chlorique.
Q : Quelle est la formule de l’acide chlorique ?
R : La formule de l’acide chlorique est HClO3.
Q : L’acide chlorique est-il ionique ou moléculaire ?
R : L’acide chlorique est moléculaire, car il est constitué d’atomes d’hydrogène, de chlore et d’oxygène liés de manière covalente.
