L’acide carbonique (H2CO3) se forme lorsque le dioxyde de carbone se dissout dans l’eau et joue un rôle crucial dans la régulation du pH des océans et dans le contrôle de l’altération des roches.
| Nom UICPA | Acide carbonique |
| Formule moléculaire | H2CO3 |
| Numero CAS | 463-79-6 |
| Synonymes | Acide de l’air; Acide aérien; H2CO3 ; Oxidaniumylidèneméthane; Carbonate acide ; l’hydroxycétone; Dihydroxyméthanone |
| InChI | InChI=1S/CH2O3/c2-1(3)4/h(H2,2,3,4) |
Formule d’acide carbonique
La formule chimique de l’acide carbonique est H2CO3, ce qui indique qu’il est composé de deux atomes d’hydrogène, d’un atome de carbone et de trois atomes d’oxygène. La formule montre également le rapport des atomes dans la molécule, ce qui est important pour déterminer la stœchiométrie des réactions chimiques impliquant l’acide carbonique.
Masse molaire de l’acide carbonique
La masse molaire de l’acide carbonique est d’environ 62,03 g/mol. C’est un acide faible qui se forme lorsque le dioxyde de carbone se dissout dans l’eau et qui est responsable de la régulation du pH des océans. La masse molaire de l’acide carbonique est importante pour calculer la quantité d’acide nécessaire pour atteindre un certain pH dans une solution et pour déterminer la quantité de dioxyde de carbone pouvant se dissoudre dans l’eau.
Point d’ébullition de l’acide carbonique
L’acide carbonique n’a pas de point d’ébullition bien défini, car il se décompose en eau et en dioxyde de carbone avant d’atteindre son point d’ébullition. Cependant, à pression atmosphérique, l’acide carbonique se décompose à une température d’environ 333 K (60 °C) en eau et en dioxyde de carbone.
Point de fusion de l’acide carbonique
L’acide carbonique n’a pas non plus de point de fusion bien défini, car il se décompose en eau et en dioxyde de carbone avant d’atteindre son point de fusion. Cependant, à pression atmosphérique, l’acide carbonique se décompose à une température d’environ 273 K (-0,15 °C) en eau et en dioxyde de carbone.
Densité de l’acide carbonique g/ml
La densité de l’acide carbonique est d’environ 1,67 g/mL à température ambiante (25 °C). Cette valeur peut varier en fonction de la concentration de la solution, ainsi que de la température et de la pression de l’environnement.
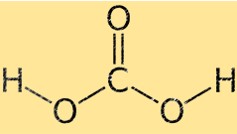
Structure de l’acide carbonique
L’acide carbonique a une géométrie moléculaire tétraédrique, avec l’atome de carbone au centre et les quatre atomes environnants (deux oxygène et deux hydrogènes) situés aux coins d’un tétraèdre. Les deux atomes d’oxygène sont liés à l’atome de carbone par des doubles liaisons, tandis que les deux atomes d’hydrogène sont liés par des liaisons simples.
Poids moléculaire de l’acide carbonique
Le poids moléculaire de l’acide carbonique est de 62,03 g/mol. Cette valeur est calculée en additionnant les poids atomiques des éléments constitutifs, qui sont l’hydrogène (H), le carbone (C) et l’oxygène (O).
| Apparence | Liquide incolore ou solide cristallin |
| Gravité spécifique | 1,67 g/cm³ |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 62,03 g/mole |
| Densité | 1,67 g/mL à température ambiante (25 °C) |
| Point de fusion | Se décompose à environ 273 K (-0,15 °C) |
| Point d’ébullition | Se décompose à environ 333 K (60 °C) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Complètement soluble |
| Solubilité | Soluble dans l’eau, l’éthanol, le méthanol |
| La pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | 3.6 (première dissociation) |
| pH | 5,6 (dans une solution 0,1 M) |
Acide carbonique Sécurité et dangers
L’acide carbonique (H2CO3) est généralement considéré comme sûr, mais il peut présenter certains dangers dans certaines situations. L’exposition au H2CO3 peut provoquer une irritation des yeux, de la peau et du système respiratoire et entraîner une toux, une respiration sifflante et un essoufflement. L’ingestion de H2CO3 peut provoquer des maux d’estomac, des nausées et des vomissements. Le H2CO3 est également un acide faible et peut réagir avec certains métaux, comme l’aluminium et le zinc, pour produire de l’hydrogène gazeux inflammable. Lors de la manipulation ou de l’utilisation du H2CO3, des mesures de sécurité appropriées doivent être prises, notamment le port de vêtements de protection et une ventilation adéquate. En cas d’exposition, des soins médicaux doivent être immédiatement recherchés.
| Symboles de danger | Aucun |
| Description de la sécurité | Non toxique |
| Numéros d’identification de l’ONU | ONU 1824 |
| Code SH | 28111990 |
| Classe de danger | 8 – Substances corrosives |
| Groupe d’emballage | III |
| Toxicité | Faible toxicité |
Méthodes de synthèse de l’acide carbonique
Le H2CO3 peut être synthétisé par différentes méthodes. Une méthode courante consiste à faire réagir le dioxyde de carbone (CO2) avec de l’eau (H2O) en présence d’un catalyseur. Ce processus, appelé hydratation, produit de l’acide carbonique :
CO2 + H2O → H2CO3
Une autre méthode de synthèse de l’acide carbonique consiste à faire réagir le carbonate de calcium (CaCO3) avec un acide, tel que l’acide chlorhydrique (HCl). Ce processus, appelé acidification, produit de l’acide carbonique :
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
La réaction entre l’acide oxalique et un carbonate, tel que le carbonate de sodium (Na2CO3), permet de synthétiser de l’acide carbonique. Ce processus produit de l’acide carbonique et un sel, comme l’oxalate de sodium :
H2C2O4 + Na2CO3 → 2H2CO3 + Na2C2O4
Le procédé Solvay produit de l’acide carbonique et du bicarbonate de sodium par la réaction du carbonate de sodium (Na2CO3) avec du dioxyde de carbone en présence d’eau.
2NaHCO3 + CO2 → Na2CO3 + H2CO3
Dans l’ensemble, il existe plusieurs méthodes disponibles pour la synthèse de l’acide carbonique, chacune ayant ses propres avantages et limites. Le choix de la méthode dépendra de facteurs tels que la pureté souhaitée du produit, la disponibilité des matières premières et l’échelle de production requise.
Utilisations de l’acide carbonique
L’acide carbonique (H2CO3) est un composé polyvalent qui trouve de nombreuses utilisations dans l’industrie, la médecine et la vie quotidienne. Certaines des principales utilisations du H2CO3 comprennent :
- Boissons gazeuses : H2CO3 est le composé responsable du pétillant caractéristique des boissons gazeuses telles que les sodas et la bière.
- Le H2CO3 tamponne le pH dans divers processus industriels, tels que le traitement de l’eau et la transformation des aliments.
- Il supprime le feu en déplaçant l’oxygène et en empêchant la combustion.
- Le H2CO3 inhibe la croissance des bactéries et des moisissures dans certains types de produits alimentaires afin de les préserver.
- Il agit comme un agent nettoyant doux, notamment pour éliminer les dépôts minéraux.
- Les professionnels de la santé utilisent le H2CO3 dans certaines applications, notamment pour traiter certaines lésions cutanées et induire une constriction bronchique lors des tests de la fonction pulmonaire.
- Les soudeurs utilisent le H2CO3 comme gaz de protection pour empêcher l’oxydation et produire des soudures plus propres.
Dans l’ensemble, l’acide carbonique est un composé utile et polyvalent qui possède un large éventail d’applications dans divers domaines.
Des questions:
Q : L’acide carbonique est-il un acide fort ?
R : L’acide carbonique est un acide faible, ce qui signifie qu’il ne se dissocie que partiellement dans l’eau pour produire des ions hydrogène (H+) et des ions bicarbonate (HCO3-). Sa constante de dissociation acide (Ka) est relativement faible, ce qui indique qu’il ne se dissocie pas complètement dans l’eau.
Q : Le dioxyde de carbone est-il acide ?
R : Le dioxyde de carbone (CO2) n’est pas intrinsèquement acide, car c’est un composé neutre qui ne produit pas d’ions hydrogène (H+) dans l’eau. Cependant, lorsque le CO2 se dissout dans l’eau, il peut réagir avec les molécules d’eau pour former de l’acide carbonique, qui est un acide faible. Cette réaction peut entraîner une diminution du pH, rendant la solution plus acide. Par conséquent, même si le CO2 lui-même n’est pas acide, il peut contribuer à l’acidité d’une solution lorsqu’il réagit avec l’eau.
