L’acide benzoïque est un solide cristallin incolore utilisé comme conservateur alimentaire et comme précurseur de nombreux autres composés organiques. Il peut être synthétisé à partir du toluène ou du benzène.
| Nom UICPA | Acide benzoique |
| Formule moléculaire | C7H6O2 |
| Numero CAS | 65-85-0 |
| Synonymes | Carboxybenzène, Acide benzèneformique, Acide phénylformique, Acide benzènecarboxylique, E210 |
| InChI | InChI=1S/C7H6O2/c8-7(9)6-4-2-1-3-5-6/h1-5H,(H,8,9) |
Masse molaire de l’acide benzoïque
L’acide benzoïque a une masse molaire de 122,12 g/mol. Il s’agit d’un composé organique simple constitué d’un cycle benzénique attaché à un groupe fonctionnel acide carboxylique. La masse molaire est calculée en additionnant les masses atomiques de tous les atomes présents dans une seule molécule du composé. Dans le cas de l’acide benzoïque, la formule est C7H6O2, la masse molaire peut donc être calculée comme suit :
7(12,01) + 6(1,01) + 2(16,00) = 122,12 g/mol
Connaître la masse molaire est important pour déterminer la quantité d’acide benzoïque nécessaire aux réactions chimiques et pour calculer d’autres propriétés telles que la concentration et la densité.
Structure de l’acide benzoïque
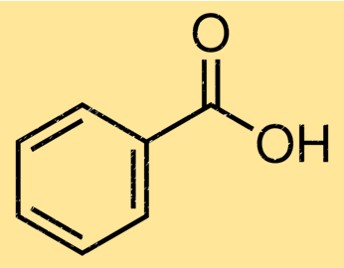
La structure de l’acide benzoïque est constituée d’un cycle benzénique attaché à un groupe fonctionnel acide carboxylique. Le cycle benzénique est un cycle carboné à six chaînons avec des doubles liaisons alternées, tandis que le groupe acide carboxylique est constitué d’un atome de carbone doublement lié à un atome d’oxygène et d’une simple liaison à un groupe hydroxyle. La structure de l’acide benzoïque est importante pour déterminer ses propriétés chimiques et physiques.
Formule d’acide benzoïque
La formule chimique de l’acide benzoïque est C7H6O2. Cette formule nous indique que chaque molécule d’acide benzoïque contient sept atomes de carbone, six atomes d’hydrogène et deux atomes d’oxygène. La formule est utilisée pour déterminer la masse molaire et le poids moléculaire de l’acide benzoïque, ainsi que le rapport des éléments présents dans le composé.
Point de fusion de l’acide benzoïque
L’acide benzoïque a un point de fusion de 122,4 °C. C’est la température à laquelle la forme solide de l’acide benzoïque commence à fondre et à se transformer en liquide. Le point de fusion est affecté par des facteurs tels que la pureté, la structure cristalline et les forces intermoléculaires. L’acide benzoïque a un point de fusion relativement élevé en raison de ses fortes forces intermoléculaires, provoquées par les liaisons hydrogène entre les groupes acide carboxylique des molécules adjacentes.
Point d’ébullition du BzOH
Le point d’ébullition du BzOH est de 249 °C. C’est la température à laquelle la forme liquide du BzOH commence à se vaporiser et à se transformer en gaz. Le point d’ébullition d’une substance est affecté par des facteurs tels que les forces intermoléculaires, la pression et la présence d’impuretés. Le BzOH a un point d’ébullition relativement élevé en raison de ses fortes forces intermoléculaires, provoquées par les liaisons hydrogène entre les groupes acide carboxylique des molécules adjacentes.
Densité BzOH g/ml
La densité du BzOH est de 1,265 g/mL. Il s’agit de la masse d’un millilitre de BzOH à une température et une pression spécifiques. La densité est une propriété physique importante utilisée pour déterminer la masse d’une substance dans un volume donné. La densité du BzOH est affectée par des facteurs tels que la température et la pression.
Poids moléculaire BzOH
Le poids moléculaire du BzOH est de 122,12 g/mol. C’est la masse d’une molécule de BzOH. Le poids moléculaire est utilisé pour déterminer le nombre de molécules dans une masse donnée d’une substance. Il est calculé en additionnant les masses atomiques de tous les atomes de la molécule.
| Apparence | Cristaux blancs |
| Gravité spécifique | 1,265 g/cm³ |
| Couleur | Incolore |
| Odeur | Faible, agréable |
| Masse molaire | 122,12 g/mole |
| Densité | 1,265 g/cm³ |
| Point de fusion | 122,4 °C |
| Point d’ébullition | 249 °C |
| Point d’éclair | 121 °C |
| Solubilité dans l’eau | 3,8 g/L |
| Solubilité | Soluble dans l’éthanol, l’éther, le benzène et le chloroforme ; légèrement soluble dans l’eau |
| Pression de vapeur | 0,00027 mmHg à 25°C |
| Densité de vapeur | 4,2 (air=1) |
| pKa | 4.2 |
| pH | 2,7 – 3,5 |
Sécurité et dangers de l’acide benzoïque
L’acide benzoïque (BzOH) peut présenter des dangers s’il est manipulé incorrectement. C’est un irritant pour la peau et les yeux et peut provoquer une irritation respiratoire s’il est inhalé à fortes concentrations. L’ingestion de grandes quantités de BzOH peut également provoquer des nausées, des vomissements et des douleurs abdominales. Le composé est inflammable et peut s’enflammer s’il est exposé à la chaleur ou aux flammes. Il est important de manipuler le BzOH avec précaution, en portant un équipement de protection approprié et en évitant tout contact avec la peau, les yeux et les muqueuses. En cas d’exposition accidentelle, les zones touchées doivent être rincées à l’eau et consulter un médecin si nécessaire. Des procédures appropriées de stockage et d’élimination doivent également être suivies pour éviter la contamination de l’environnement.
| Symboles de danger | XI |
| Description de la sécurité | Eviter le contact avec la peau et les yeux; Portez des gants de protection/des lunettes de protection ; En cas de contact avec les yeux, rincer immédiatement et abondamment à l’eau et consulter un médecin ; Conserver dans un endroit sec à l’abri de la chaleur et des matières incompatibles ; Gardez les récipients bien fermés. |
| Identifiants ONU | ONU 3077 (ADR/RID), ONU 1220 (IMDG), ONU 3077 (OACI) |
| Code SH | 2916.31.00 |
| Classe de danger | 9 (Matières et objets dangereux divers) |
| Groupe d’emballage | III |
| Toxicité | L’acide benzoïque est relativement non toxique, avec une DL50 orale chez le rat de 1 700 à 1 940 mg/kg. Il peut provoquer une irritation de la peau et des yeux ainsi qu’une irritation respiratoire en cas d’inhalation à fortes concentrations. L’ingestion de grandes quantités peut également provoquer des troubles gastro-intestinaux. |
Méthodes de synthèse de l’acide benzoïque
On peut synthétiser l’acide benzoïque (BzOH) par diverses méthodes.
Une méthode courante consiste à oxyder le toluène ou le chlorure de benzyle à l’aide de permanganate de potassium ou d’acide chromique. Une autre méthode implique la réaction du benzène avec du dioxyde de carbone et un catalyseur métallique, tel que l’oxyde de cuivre ou de magnésium, en présence de chaleur et de pression.
On peut obtenir du BzOH par hydrolyse du benzamide, du chlorure de benzoyle ou du benzotrifluorure en utilisant une base forte, telle que l’hydroxyde de sodium. Ce processus donne du BzOH et l’amine ou l’alcool correspondant. Alternativement, on peut obtenir du BzOH en faisant réagir l’alcool benzylique avec du permanganate de potassium ou du dichromate de sodium.
On peut utiliser un réactif de Grignard, formé en faisant réagir du magnésium et un halogénure d’alkyle ou d’aryle, avec du dioxyde de carbone pour synthétiser du BzOH. Pour convertir l’acide carboxylique résultant en BzOH, on peut acidifier la solution.
On peut produire du BzOH en oxydant le toluène en présence d’un catalyseur au cobalt ou au manganèse. Cette méthode est particulièrement utile pour la production à grande échelle.
Chacune de ces méthodes de synthèse présente des avantages et des inconvénients en fonction de l’application spécifique et de l’échelle de production. Il est important de choisir la méthode la plus appropriée en fonction de facteurs tels que le coût, l’efficacité et l’impact environnemental.
Utilisations de l’acide benzoïque
- Les gens utilisent couramment l’acide benzoïque (BzOH) comme conservateur alimentaire car il peut inhiber la croissance des bactéries et des champignons.
- Les fabricants l’utilisent comme intermédiaire dans la synthèse de divers produits chimiques, notamment des colorants, des parfums et des produits pharmaceutiques.
- Les producteurs utilisent le BZOH dans la fabrication de plastifiants, tels que le benzoate de benzyle, qui sont utilisés dans la production de PVC et d’autres plastiques.
- Il joue un rôle essentiel dans la production de phénol, utilisé dans la fabrication de résines, d’adhésifs et de désinfectants.
- Les fabricants ajoutent du BZOH aux aliments pour animaux pour empêcher la croissance de moisissures et de bactéries.
- Il agit comme un précurseur du peroxyde de benzoyle, utilisé dans le traitement de l’acné.
- Les producteurs utilisent le BZOH dans la production de divers types de polymères, notamment le polyester, le nylon et le polyuréthane.
- Les industries l’utilisent comme solvant pour divers composés organiques, notamment les résines, les huiles et les cires.
- Les fabricants utilisent le BZOH dans la production de divers types de sels, tels que le benzoate de sodium, qui sont utilisés comme conservateurs alimentaires et agents antimicrobiens.
- BZOH est utilisé dans la production de divers types de détergents, notamment des détergents à lessive, des détergents à vaisselle et des agents de nettoyage.
Des questions:
Q : L’acide benzoïque est-il soluble dans l’eau ?
R : Le BzOH est peu soluble dans l’eau, avec une solubilité de 3,4 g/L à 25°C. Cependant, il est plus soluble dans les solvants organiques tels que l’éthanol et l’acétone.
Q : L’acide benzoïque est-il un acide fort ?
R : Non, le BzOH est un acide faible. Dans l’eau, il se dissocie partiellement pour former des ions hydronium et des ions benzoate. Sa constante de dissociation (Ka) est de 6,5 x 10^-5, indiquant sa faible nature acide.
Q : Une solution d’acide benzoïque (C6H5COOH) 0,20 M a un pH de 2,45. Qu’est-ce que Ka pour l’acide benzoïque ?
R : Le Ka du BzOH peut être calculé en utilisant le pH de la solution et la concentration de l’acide. En utilisant le pH de 2,45 et l’équation de dissociation du BzOH, le Ka est calculé comme étant de 6,5 x 10^-5.
Q : L’acide benzoïque est-il polaire ou non polaire ?
R : L’acide benzoïque est une molécule polaire en raison de la présence du groupe fonctionnel acide carboxylique, qui contient un atome d’oxygène électronégatif qui crée un moment dipolaire.
